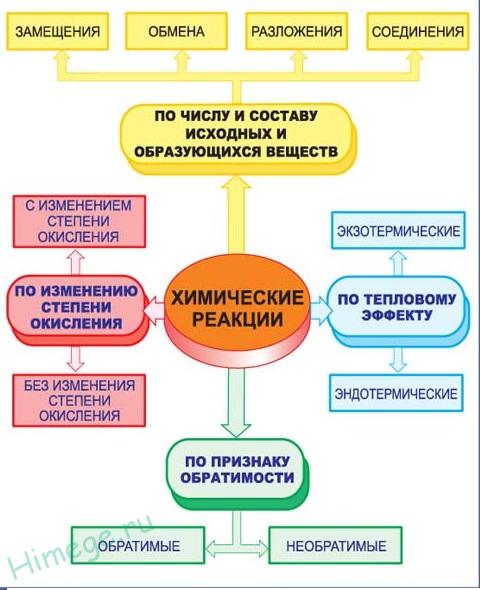
Классификацию химических реакций в неорганической и органической химии осуществляют на основании различных классифицирующих признаков, сведения о которых приведены в таблице ниже.
По изменению степени окисления элементов
Первый признак классификации — по изменению степени окисления элементов, образующих реагенты и продукты.
а) окислительно-восстановительные
б) без изменения степени окисления
Окислительно-восстановительными называют реакции, сопровождающиеся изменением степеней окисления химических элементов, входящих в состав реагентов. К окислительно-восстановительным в неорганической химии относятся все реакции замещения и те реакции разложения и соединения, в которых участвует хотя бы одно простое вещество. К реакциям, идущим без изменения степеней окисления элементов, образующих реагенты и продукты реакции, относятся все реакции обмена.
По числу и составу реагентов и продуктов
Химические реакции классифицируются по характеру процесса, т.е по числу и составу реагентов и продуктов.
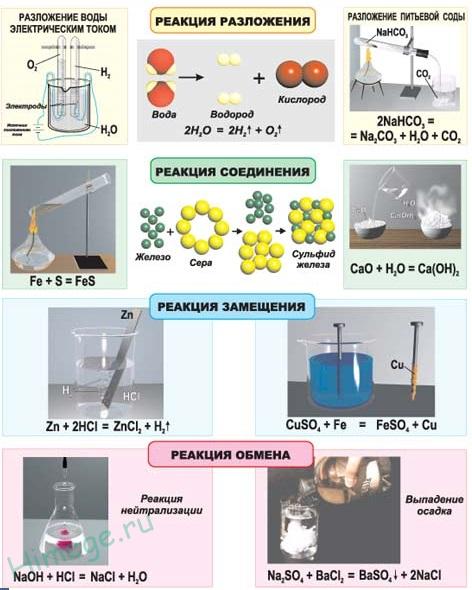
Реакциями соединения называют химические реакции, в результате которых сложные молекулы получаются из нескольких более простых, например:
4Li + O2 = 2Li2O
Реакциями разложения называют химические реакции, в результате которых простые молекулы получаются из более сложных, например:
CaCO3 = CaO + CO2
Реакции разложения можно рассматривать как процессы, обратные соединению.
Реакциями замещения называют химические реакции, в результате которых атом или группа атомов в молекуле вещества замещается на другой атом или группу атомов, например:
Fe + 2HCl = FeCl2 + H2
Их отличительный признак — взаимодействие простого вещества со сложным. Такие реакции есть и в органической химии.
Однако понятие «замещение» в органике шире, чем в неорганической химии. Если в молекуле исходного вещества какой-либо атом или функциональная группа заменяются на другой атом или группу, это тоже реакции замещения, хотя с точки зрения неорганической химии процесс выглядит как реакция обмена.
— обмена (в том числе и нейтрализации).
Реакциями обмена называют химические реакции, протекающие без изменения степеней окисления элементов и приводящие к обмену составных частей реагентов, например:
AgNO3 + KBr = AgBr + KNO3
|
|
По возможности протекать в обратном направлении
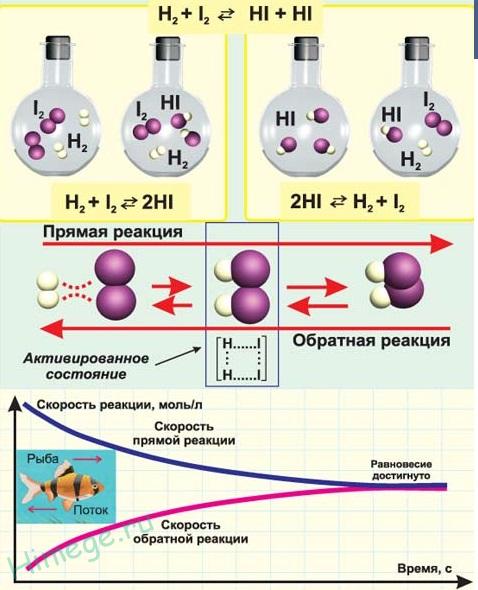
По возможности протекать в обратном направлении – обратимые и необратимые.
Обратимыми называют химические реакции, протекающие при данной температуре одновременно в двух противоположных направлениях с соизмеримыми скоростями. При записи уравнений таких реакций знак равенства заменяют противоположно направленными стрелками. Простейшим примером обратимой реакции является синтез аммиака взаимодействием азота и водорода:
N2 +3H2↔2NH3
Необратимыми называют реакции, протекающие только в прямом направлении, в результате которых образуются продукты, не взаимодействующие между собой. К необратимым относят химические реакции, в результате которых образуются малодиссоциированные соединения, происходит выделение большого количества энергии, а также те, в которых конечные продукты уходят из сферы реакции в газообразном виде или в виде осадка, например:
HCl + NaOH = NaCl + H2O
2Ca + O2 = 2CaO
BaBr2 + Na2SO 4 = BaSO4↓ + 2NaBr
|
|
По тепловому эффекту
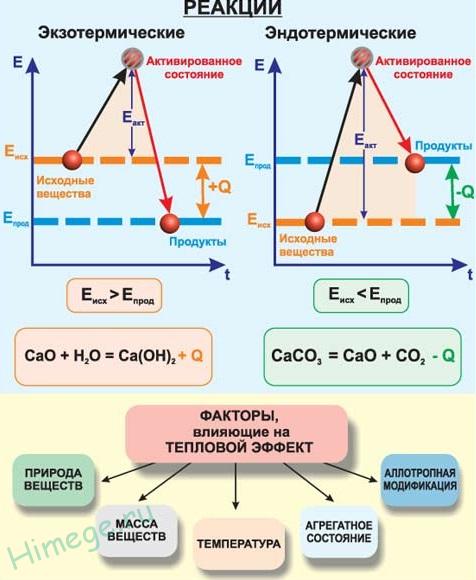
Экзотермическими называют химические реакции, идущие с выделением теплоты. Условное обозначение изменения энтальпии (теплосодержания) ΔH, а теплового эффекта реакции Q. Для экзотермических реакций Q > 0, а ΔH < 0.
Эндотермическими называют химические реакции, идущие с поглощением теплоты. Для эндотермических реакций Q < 0, а ΔH > 0.
Реакции соединения как правило будут реакциями экзотермическими, а реакции разложения — эндотермическими. Редкое исключение — реакция азота с кислородом — эндотермическая:
N2 + О2 → 2NO – Q
По фазе
Гомогенными называют реакции, протекающие в однородной среде (однородные вещества, в одной фазе, например г-г, реакции в растворах).
Гетерогенными называют реакции, протекающие в неоднородной среде, на поверхности соприкосновения реагирующих веществ, находящихся в разных фазах, например, твердой и газообразной, жидкой и газообразной, в двух несмешивающихся жидкостях.
По использованию катализатора
Катализатор – вещество ускоряющее химическую реакцию.
Каталитические реакции протекают только в присутствии катализатора (в том числе и ферментативные).
Некаталитические реакции идут в отсутствие катализатора.
По типу разрыва связей
По типу разрыва химической связи в исходной молекуле различают гомолитические и гетеролитические реакции.
Гомолитическими называются реакции, при которых в результате разрыва связей образуются частицы, имеющие неспаренный электрон — свободные радикалы.
Гетеролитическими называют реакции, протекающие через образование ионных частиц — катионов и анионов.
|
|
· гомолитические (равный разрыв, каждый атом по 1 электрону получает)
· гетеролитический (неравный разрыв – одному достается пара электронов)
Радикальными (цепными) называют химические реакции с участием радикалов, например:
CH4 + Cl2 hv →CH3Cl + HCl
Ионными называют химические реакции, протекающие с участием ионов, например:
KCl + AgNO3 = KNO3 + AgCl↓
Электрофильными называют гетеролитические реакции органических соединений с электрофилами — частицами, несущими целый или дробный положительный заряд. Они подразделяются на реакции электрофильного замещения и электрофильного присоединения, например:
C6H6 + Cl2 FeCl3→ C 6 H 5 Cl + HCl
H2C =CH2 + Br2 → BrCH2 –CH2Br
Нуклеофильными называют гетеролитические реакции органических соединений с нуклеофилами — частицами, несущими целый или дробный отрицательный заряд. Они подразделяются на реакции нуклеофильного замещения и нуклеофильного присоединения, например:
CH3Br + NaOH → CH3OH + NaBr
CH3C(O)H + C2H5OH → CH3CH(OC2H5)2 + H2O