В зависимости от вида фиксированных ионов и обменивающихся катионов экспериментально установлены различные ряды селективности катионов.
При обмене на сильнокислотном сульфокатионите однозарядных ионов установлен следующий ряд селективности:
Li+ < H+< Na+ < NH4+ < K+ < Rb+ < Cs+ < Ag+ < Tl+.
Ионный обмен двухзарядных ионов характеризуется следующим рядом:
Mg2+ < Ca2+< Sr2+< Ba2+< Ra2+
Каждый последующий член ряда сорбируется более селективно, чем предыдущий. Определяющим фактором этих рядов селективности служит изменение энергии гидратации. Поскольку энергия гидратации уменьшается с увеличением размеров ионов, то избирательность сульфокатионита к катионам возрастает с увеличением их радиуса. Электростатическое взаимодействие в данном случае мало влияет на селективность обмена, поскольку фиксированный сульфоанион имеет большой размер и слабое силовой поле.
Для разнозарядных катионов селективность растет с возрастанием заряда. В этом случае преобладающее влияние на селективность оказывает электростатическое взаимодействие, которое растет с увеличением радиуса иона.
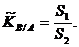 |
В случае слабокислотных карбоксильных и катионитов, а также смол с фосфатными группами наблюдается обратные ряды селективности катионов по сравнению с сульфокатионитом, например для щелочных металлов:
Li+ >Na+ > K+ > Rb+ > Cs+.
Эти катиониты проявляют тенденцию к большей избирательности по отношению к ионам малого радиуса, объясняется это преобладающим влиянием на селективность энергии электростатического взаимодействия. Так, например, фиксированный анион -СОО- имеет меньшие размеры, чем группа -SO3-, кроме того на один атом кислорода приходится заряд -1/2, вместо -1/3, как у сульфогруппы, оба эти фактора способствуют увеличению энергии электростатического взаимодействия.
Ряды селективности анионов
В анионитах фиксированные ионы состоят из большого числа атомов, имеют крупные размеры и положительный заряд, равный единице. Поскольку в ряде случаев приближение противоионов к фиксированным катионам пространственно затруднено, поэтому определяющую роль играет не электростатическое взаимодействие между ними, а изменение энергии гидратации анионов при переходе из внешнего раствора в ионит. Аналогично катионитам, менее гидратированнные анионы переходят из раствора в фазу ионита. Энергия гидратации ионов одинакового заряда уменьшается с увеличением радиуса иона, что объясняет ряд селективности поглощения однозарядных ионов на высокоосновным анионитом
OH- < F- < HCOO- < Cl- < HSO3- < Br- < NO3- < HSO4- < I-< ClO4-.
Кроме того, крупные анионы в большей степени нарушают структуру воды, чем анионы меньшего размера. Вследствие этого, выгоднее более выгоден их переход в фазу смолы, где структура воды менее упорядочена. Поэтому, при одинаковом заряде анионы меньшего размера вытесняются из ионита анионами большего размера. Это объясняет высокую селективность сильноосновных анионитов в отношении крупных однозарядных ионов AuCl4-, ReO4-, MnO4-, ClO4-.
С увеличением заряда анионов селективность их поглощения понижается, так как энергия гидратации увеличивается. Степень гидратации многооатомных анионов зависит не только от размера, но и от структурных факторов, особенно от наличия гидрофильных групп, определяющих взаимодействие с молекулами воды. Ряды селективности анионов характерны для высокоосновных анионитов, данные же о сорбции на низкоосновных анионитах практически не поддаются обобщению.
Как для катионитов, так и для анионитов селективность растет с увеличением степени сшивки, уменьшающей набухание.
Изотермы ионного обмена
Задачей как аналитического, так и графического описания ионообменного равновесия заключается в изображении зависимости между составами фаз ионита и раствора. В отличие от других гетерогенных систем ионообменные системы мало чувствительны к изменению температуры, поэтому изотермы ионного обмена не относятся к строго определенной температуре, а обычно характеризуют равновесие в области температур от 15 до 30 °С. Изотермы ионного обмена графически изображают зависимость между эквивалентной долей иона в ионите и эквивалентной долей его в растворе при установлении равновесия между ионами, изменяющиеся в интервале от 0 до 1, так называемая квадратная диаграмма.

3.5.3. КИНЕТИКА ИОННОГО ОБМЕНА
Механизм ионообменного процесса включает следующие стадии:
1) диффузия ионов, поглощаемых ионитом из сплошной фазы раствора электролита к пленке раствора, непосредственно прилегающей к зерну ионита,
2) диффузия поглощаемых ионов к поверхности зерна через пленку раствора, в которой не происходит перемешивания,
3) диффузия поглощаемых ионов к месту расположения функциональных групп в объеме зерна,
4) акт обмена поглощаемых ионов на противоионы ионита,
5) диффузия вытесняемых ионов в объеме зерна к поверхности,
6) диффузия вытесняемых ионов через пленку,
7) диффузия вытесняемых ионов в объем раствора.
Ионный обмен, в целом, является хемосорбционным процессом: обменные химические реакции внутри ионитов обычно идут со скоростями значительно большими, чем диффузия ионов, наиболее медленными, а следовательно, определяющими общую скорость процесса являются стадии 2, 6 – пленочная диффузия и стадии 3, 5 – гелевая диффузия. На скорость ионного обмена значительное влияние оказывает концентрация раствора электролита. Взаимодействия между электролитами с низкой концентрацией поглощаемых ионов в растворе (менее 0,003 моль/л) и ионитами с большой обменной емкостью при малой степени сшивки, скорость обмена контролируется внешней (пленочной) диффузией. В переходной области существует смешанная кинетика, где учитываются обе диффузионные стадии. В концентрированных растворах (более 0,1 моль/л) и больших степенях сшивки процесс лимитируется диффузией ионов в зерне и описывается гелевой кинетикой. Наиболее простой и надежный метод экспериментального определения лимитирующей стадии – метод прерывания ионного обмена. При гелевой кинетике после перерыва начальная скорость обмена выше, чем до перерыва, так как концентрация в зерне выравнивается и начальный градиент концентраций возрастает. В случае пленочной кинетики кривая поглощения не имеет перегиба.