Термодинамика изучает наиболее общие тепловые свойства макросистем, находящихся в равновесных состояниях, и процессы перехода между такими состояниями. В отличие от молекулярно-кинетической теории термодинамика не связывает эти свойства и процессы со строением и внутренней структурой систем.
Важнейшим понятием в термодинамике является понятие внутренней энергии системы U. Согласно молекулярно-кинетической теории внутренняя энергия равна сумме кинетической энергии беспорядочного движения всех молекул системы относительно её центра масс и потенциальной энергии взаимодействия этих молекул между собой. В термодинамике внутренняя энергия определяется через значения макроскопических параметров системы, которые можно измерить на опыте. В частности, для идеального газа, в котором предполагается, что молекулы не взаимодействуют между собой, потенциальная энергия считается равной нулю. Тогда внутренняя энергия идеального газа представляет собой полную кинетическую энергию его хаотически движущихся молекул.
Средняя кинетическая энергия поступательного движения одной молекулы идеального одноатомного газа равна
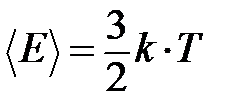 ,
,
Тогда внутренняя энергия
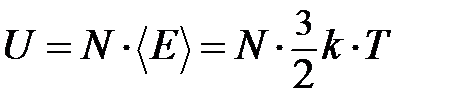 , (1)
, (1)
где 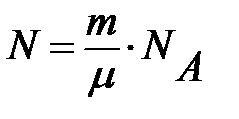 – полное число молекул.
– полное число молекул.
Формула внутренней энергии одноатомного идеального газа будет иметь вид:
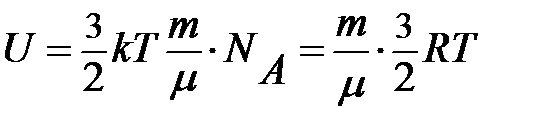 (2)
(2)
Эта формула показывает прямую зависимость внутренней энергии идеального газа от абсолютной температуры и массы газа, которые являются макропараметрами данной системы.
Изменение внутренней энергии данной системы газа происходит только при изменении его температуры:
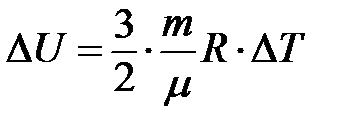 (3)
(3)
Для идеального газа, состоящего из сложных молекул, коэффициент пропорциональности 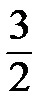 заменяется на
заменяется на 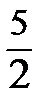 - для двухатомного газа, на
- для двухатомного газа, на 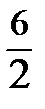 – для многоатомного газа. Это связано с тем, что сложные молекулы участвуют не только в поступательном, но и во вращательном движении. При очень высоких температурах следует учитывать и колебания атомов, что также влияет на величину коэффициента.
– для многоатомного газа. Это связано с тем, что сложные молекулы участвуют не только в поступательном, но и во вращательном движении. При очень высоких температурах следует учитывать и колебания атомов, что также влияет на величину коэффициента.
Используя уравнение состояния идеального газа
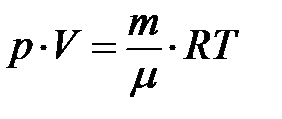
| Рис.1 |
 (4)
(4)
При соприкосновении тел происходит обмен энергиями, как механической, так и внутренней. Существуют два способа изменения внутренней энергии: путем совершения работы и путем сообщения количества теплоты.
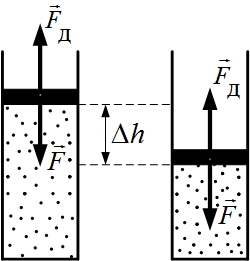
Рассмотрим первый способ на примере квазистатического сжатия идеального газа при перемещении поршня в цилиндрическом сосуде. При медленном перемещении поршня вниз молекулы газа испытывают упругие соударения с поршнем, в результате чего их кинетическая энергия увеличивается, т.к. при каждом соударении поршень передает молекуле дополнительный импульс. Это значит, что будет возрастать температура газа и, следовательно, его внутренняя энергия. При расширении газа, наоборот, его температура и внутренняя энергия уменьшаются. В рассматриваемом примере происходит перемещение поршня под действием внешней силы  . Так как процесс сжатия (расширения) происходит с очень малой скоростью, то можно считать, что сила
. Так как процесс сжатия (расширения) происходит с очень малой скоростью, то можно считать, что сила  равна по модулю силе давления
равна по модулю силе давления 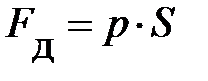 со стороны газа на поршень (
со стороны газа на поршень (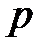 – давление газа,
– давление газа, 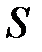 – площадь поршня).
– площадь поршня).
При малом перемещении поршня 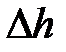 изменением давления газа можно пренебречь, тогда работа
изменением давления газа можно пренебречь, тогда работа 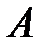 силы
силы  равна:
равна:
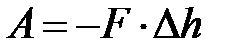 .
.
Знак «–» учитывает, что при сжатии газа высота станет уменьшаться.
Работа же силы давления газа при его сжатии будет противоположной по знаку:
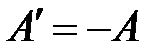 .
.
Или, учитывая выражение 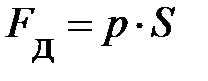 ,
,
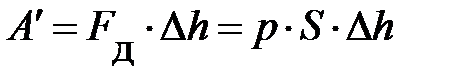 .
.
Но 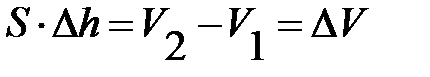 – изменение объёма, тогда работа газа
– изменение объёма, тогда работа газа
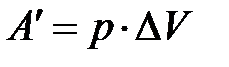 . (5)
. (5)
При сжатии величина 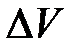 отрицательна, то есть работа А внешних сил положительна. И, наоборот, при расширении газа работа А внешних сил отрицательна.
отрицательна, то есть работа А внешних сил положительна. И, наоборот, при расширении газа работа А внешних сил отрицательна.

| Рис.2 |
Выражение работы газа получено в предположении, что процесс – изобарный. Чтобы определить работу газа в случае произвольного процесса, нужно рассмотреть графическое представление этих процессов в осях p-V.
В случае изобарного процесса (рис 2, а) согласно формуле (5), работа газа равна площади прямоугольника, ограниченного графиком процесса перехода системы из одного состояния в другое.
В случае произвольного процесса разобьем этот процесс на малые участки и будем считать, что изменение объема Δ Vi на каждом из них так мало, что происходит при практически постоянном давлении pi. Тогда элементарная работа 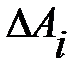 на этом участке будет определяться выражением:
на этом участке будет определяться выражением:
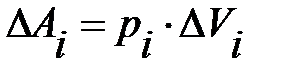 .
.
Эта величина будет численно равна площади малого прямоугольника (рис.5.2, б). Полная работа газа при переходе из состояния 1 в состояние 2 будет равна сумме элементарных работ 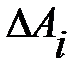 :
:
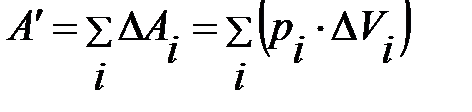 .
.
По рисунку это – площадь всей фигуры под графиком процесса от точки 1 до точки 2. При переходе к бесконечно малым величинам элементарная работа на интервале 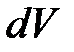 будет равна
будет равна
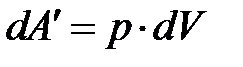 .
.
Полная работа, совершаемая газом при переходе из состояния 1 в состояние 2, будет равна
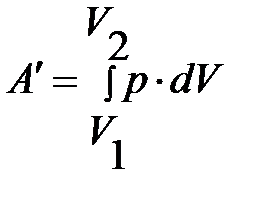 . (6)
. (6)
Работа газа зависит от процесса, которым был переведен газ из начального состояния в конечное.
Рассмотрим второй способ изменения внутренней энергии газа. Если в цилиндре с идеальным газом закрепить поршень, то изменение давления газа под поршнем не вызовет его перемещения, и работа не будет совершаться. Изохорное изменение давления газа возможно только при изменении его температуры, а, следовательно, и внутренней энергии. Это значит, что в данном случае для изменения давления идеального газа ему необходимо сообщить (или отнять от газа) некоторую энергию, не совершая при этом работу. Такой процесс передачи энергии от одного тела к другому без совершения работы называется теплообменом или теплопередачей. Количественная мера изменения внутренней энергии при теплообмене называется количеством теплоты.
Процесс теплопередачи объясняется с точки зрения молекулярно-кинетической теории. На границе раздела двух тел происходит взаимодействие молекул, имеющих различные значения средней кинетической энергии. Результатом процесса теплообмена является выравнивание значений энергии за счет передачи некоторого ее количества от молекул с высокой энергией к молекулам с низким запасом энергии. В этом состоит суть процесса теплопередачи.
Количество теплоты Q, которое получает (теряет) тело или система в процессе теплопередачи, идет на увеличение (уменьшение) его внутренней энергии. При этом (в общем случае) изменяется температура, так что
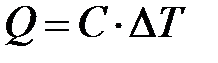 . (7)
. (7)
Величину Q считают положительной, если система получает теплоту, и отрицательной, если система теплоту отдаёт.
Таким образом, изменить внутреннюю энергию системы заданной массы можно путем или теплопередачи, или совершения над этой системой работы.
Теплоемкость. Связь между молярными теплоемкостями
Количество теплоты, получаемое системой в процессе теплопередачи, определяется формулой:
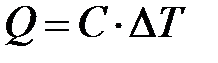 ,
,
где C – теплоемкость тела (системы). Выражая величину C, получаем:
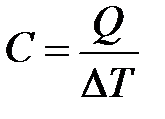 ;
;
размерность теплоёмкости тела (системы):
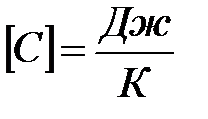 ;
;
Теплоемкость тела характеризует количество теплоты, необходимое для нагревания этого тела на один градус. Эту величину неудобно использовать на практике, так как для одного и того же вещества, но разной массы теплоемкость будет разной. Вводится понятие удельной теплоемкости: удельная теплоемкость 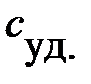 характеризует количество теплоты, необходимое для нагревания одного килограмма вещества на один градус:
характеризует количество теплоты, необходимое для нагревания одного килограмма вещества на один градус:
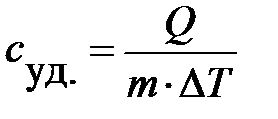 ;
;
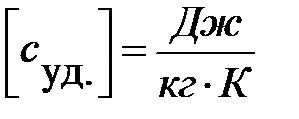 .
.
Удельная теплоемкость практически не зависит от температуры, но существенно зависит от рода вещества, его агрегатного состояния, а также от того, в каком процессе осуществляется теплопередача. Например, при изобарном нагревании газа, газ, расширяясь, совершает работу. На нагревание газа на 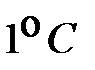 при постоянном давлении требуется большее количество теплоты, чем на нагревание при постоянном объеме. Поэтому удельная теплоемкость газа в изобарном процессе больше, чем в изохорном.
при постоянном давлении требуется большее количество теплоты, чем на нагревание при постоянном объеме. Поэтому удельная теплоемкость газа в изобарном процессе больше, чем в изохорном.
Теплоемкость тела (системы) С связана с удельной теплоемкостью выражением:
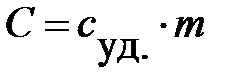 .
.
В теории газов чаще используют молярную теплоемкость  . Молярная теплоемкость характеризует количество теплоты, которое необходимо для нагревания одного моля вещества на один градус:
. Молярная теплоемкость характеризует количество теплоты, которое необходимо для нагревания одного моля вещества на один градус:
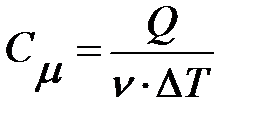 ;
;
 .
.
Связь между молярной и удельной теплоемкостью выражается формулой:
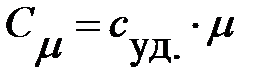 .
.
Молярная теплоемкость зависит от условий нагревания, так же как и удельная теплоемкость. Молярная теплоёмкость при постоянном давлении больше, чем при постоянном объёме:
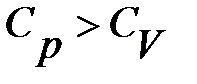 .
.
Кроме того, молярная теплоемкость при высоких температурах также изменяется. Связь между молярными теплоемкостями при постоянном давлении и постоянном объеме будет показана ниже.
Тепловое равновесие – это состояние системы, при котором все ее макроскопические параметры остаются неизменными сколь угодно долго.
Величины, характеризующие состояние макроскопических тел без учета их молекулярного строения, называются макроскопическими параметрами. К ним относятся давление и температура, объем, масса, концентрация отдельных компонентов смеси газа и др. В состоянии теплового равновесия отсутствует теплообмен с окружающими телами, отсутствуют переходы вещества из одного агрегатного состояния в другое, не меняются температура, давление, объем.
Любая термодинамическая система переходит самопроизвольно в состояние теплового равновесия. Каждому состоянию теплового равновесия, в которых может находиться термодинамическая система, соответствует определенная температура.
Важно!
В состоянии теплового равновесия объем, давление могут быть различными в разных частях термодинамической системы, и только температура во всех частях термодинамической системы, находящейся в состоянии теплового равновесия, является одинаковой. Микроскопические процессы внутри тела не прекращаются и при тепловом равновесии: меняются положения молекул, их скорости при столкновениях.
Теплопередача
Теплопередача – процесс изменения внутренней энергии тела без совершения работы.
Существуют три вида теплопередачи: теплопроводность, конвекция и излучение (лучистый теплообмен). Теплопередача происходит между телами, имеющими разную температуру. Тепло передается от тела с более высокой температурой к телу с более низкой температурой.
Теплопроводность – это процесс переноса энергии от более нагретых тел (частей тела) к менее нагретым в результате движения и взаимодействия частиц тела. Высокую теплопроводность имеют металлы – так, лучшие проводники тепла – медь, золото, серебро. Теплопроводность жидкостей меньше, а газы являются плохими проводниками тепла. Пористые тела плохо проводят тепло, так как в порах содержится воздух. Вещества с низкой теплопроводностью используют в качестве теплоизоляторов. Теплопроводность невозможна в вакууме. При теплопроводности не происходит переноса вещества.
Явление теплопроводности газов аналогично явлению диффузии. Быстрые молекулы из слоя с более высокой температурой перемещаются в более холодный слой, а молекулы из холодного слоя перемещаются в более нагретый. За счет этого средняя кинетическая энергия молекул более теплого слоя уменьшается, и его температура становится ниже.
В жидкостях и твердых телах при повышении температуры какого-либо участка твердого тела или жидкости его частицы начинают колебаться сильнее. Соударяясь с соседними частицами, где температура ниже, эти частицы передают им часть своей энергии, и температура этого участка возрастает.
Конвекция – перенос энергии потоками жидкости или газа.
Объяснить механизм конвекции можно на основе теплового расширения тел и закона Архимеда. При нагревании объем жидкости увеличивается, а плотность уменьшается. Нагретый слой под действием силы Архимеда поднимается вверх, а холодный опускается вниз. Это естественная конвекция. Она возникает при неравномерном нагревании жидкости или газа снизу в поле тяготения.
При вынужденной конвекции перемещение вещества происходит под действием насосов, лопастей вентилятора. Такая конвекция применяется в состоянии невесомости. Интенсивность конвекции зависит от разности температур слоев среды и агрегатного состояния вещества. Конвекционные потоки поднимаются вверх. При конвекции происходит перенос вещества.
В твердых телах конвекция невозможна, так как частицы не могут из-за сильного взаимодействия покидать свои места. В вакууме конвекция также невозможна.
Примером конвективных потоков в природе являются ветры (бризы дневной и ночной, муссоны).
Излучение (лучистый теплообмен) – перенос энергии электромагнитными волнами. Перенос тепла излучением возможен в вакууме. Источником излучения является любое тело, температура которого отлична от нуля К. При поглощении энергия теплового излучения переходит во внутреннюю энергию. Темные тела быстрее нагреваются излучением, чем тела с блестящей поверхностью, но и остывают быстрее. Мощность излучения зависит от температуры тела. С увеличением температуры тела энергия излучения увеличивается. Чем больше площадь поверхности тела, тем интенсивнее излучение.
В случае изолированной системы теплообмен с окружающими телами отсутствует (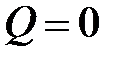 ) и работа не совершается (
) и работа не совершается (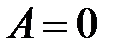 ), поэтому
), поэтому 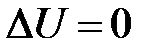 . То есть внутренняя энергия изолированной системы в любых процессах остается неизменной (
. То есть внутренняя энергия изолированной системы в любых процессах остается неизменной (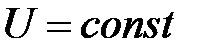 ). Между телами изолированной системы может происходить теплообмен, то есть процесс передачи внутренней энергии без совершения работы. Горячие и холодные тела приводятся в соприкосновение, в результате чего горячие тела отдают некоторое количество теплоты, а холодные его получают. Тепло поглощается в процессах нагревания:
). Между телами изолированной системы может происходить теплообмен, то есть процесс передачи внутренней энергии без совершения работы. Горячие и холодные тела приводятся в соприкосновение, в результате чего горячие тела отдают некоторое количество теплоты, а холодные его получают. Тепло поглощается в процессах нагревания:
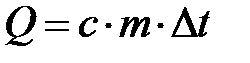 ,
,
плавления:
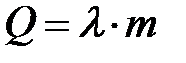 ,
,
и парообразования:
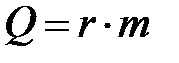 ,
,
где 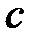 – удельная теплоемкость тела,
– удельная теплоемкость тела, 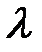 – удельная теплота плавления,
– удельная теплота плавления, 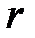 – удельная теплота парообразования. Тепло выделяется в процессах охлаждения, кристаллизации, конденсации и сгорания топлива:
– удельная теплота парообразования. Тепло выделяется в процессах охлаждения, кристаллизации, конденсации и сгорания топлива:
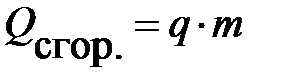 ;
;
здесь 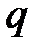 – удельная теплота сгорания топлива.
– удельная теплота сгорания топлива.
При отсутствии потерь тепловой энергии при передаче тепла от одних тел к другим согласно закону сохранения энергии количество теплоты, поглощенное одними телами в процессе нагревания, плавления или парообразования равно количеству теплоты, выделенному другими телами в процессах охлаждения, кристаллизации, конденсации или сгорания топлива. Уравнение вида
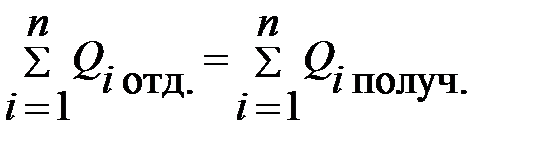
называется уравнением теплового баланса. В этом уравнении n – число тел в системе. Это уравнение представляет собой закон сохранения энергии термодинамической системы.