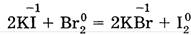Раздел 2. Многообразие веществ
Тема 3. Неметаллы
Урок: 2.3.1. Общая характеристика неметаллов по их положению в периодической системе химических элементов Д.И. Менделеева. Закономерности изменения в периодах и группах физических и химических свойств простых веществ, высших оксидов и кислородсодержащих кислот, водородных соединений, образованных неметаллами II-III периодов.
План: 1. Общая характеристика неметаллов.
Положение неметаллов в периодической системе Д.И Менделеева.
Физические свойства.
Химические свойства.
Краткая характеристика оксидов неметаллов и соответствующих им гидроксидов.
Краткая характеристика водородных соединений неметаллов.
Общая характеристика неметаллов.
Из 114 известных элементов более 20 относятся к неметаллам. Роль неметаллов и их соединений в природе очень велика. Неметаллы составляют более 84% от массы почвы, 98,5% от массы растений и 97,6% от массы тела человека. Шесть неметаллов — углерод, водород, кислород, азот, фосфор и сера — являются органогенными элементами, так как входят в состав молекул белков, жиров, углеводов и нуклеиновых кислот.
Воздух, которым мы дышим, представляет собой смесь простых и сложных веществ, образуемых неметаллами (кислород О2, азот N2, углекислый газ СО2, аргон Аг и другие благородные газы).
Положение неметаллов в периодической системе Д.И Менделеева.
Неметаллы в периодической системе расположены справа от диагонали «бор — астат». Это элементы главных подгрупп III, IV, V, VI, VII и VIII групп.
К неметаллам относятся: бор В, углерод С, кремний Si, азот N, фосфор Р, мышьяк As, кислород О, сера S, селен Se, теллур Те, водород Н, фтор F, хлор С1, бром Вг, йод I, астат At. К неметаллам также относятся благородные газы: Не — гелий, Ne — неон, Аг — аргон, Кг — криптон, Хе — ксенон, Rn — радон.
Среди неметаллов два элемента — водород и гелий — относятся к s-семейству, все остальные принадлежат к р-семейству.
На внешнем электронном слое у атомов неметаллов находится различное число электронов: у атома водорода — один электрон, у атома гелия — два электрона, у атома бора — три электрона.
Однако атомы большинства неметаллов, в отличие от атомов металлов, на внешнем электронном слое имеют большое число электронов — от 4 до 8; их электронные конфигурации изменяются от атомов элементов главной подгруппы IV группы до атомов инертных газов.
Характеристика неметалличности
Для атомов неметаллов характерной является способность присоединять электроны для завершения электронного октета — устойчивой конфигурации 8е-.
Способность присоединять электроны обусловливает окислительные свойства неметаллов.
Если у атома неметалла на внешнем электронном слое имеется 4 электрона, то для завершения октета он присоединяет 4 е; при наличии 5 электронов — Зе, 6 электронов — 2е и 7 электронов — 1е. В связи с этим характерные степени окисления атомов неметаллов в соединениях соответственно равны —4, —3, —2, —1.
Окислительные свойства неметаллов определяются их положением в периодической системе. В периодах окислительные свойства увеличиваются слева направо, в подгруппах — уменьшаются сверху вниз. Это обусловлено тем, что в периодах слева направо увеличиваются электроотрицательность, а в главных подгруппах сверху вниз эта характеристика элементов уменьшается.
По сравнению со всеми остальными неметаллами 2-го периода у атома фтора заряд ядра максимальный, радиус атома — минимальный. Поэтому атом фтора способен наиболее легко присоединять недостающий до октета электрон. Фтор характеризуется наибольшей электроотрицательностью и, следовательно, проявляет самые сильные окислительные свойства.
Рассматривая изменение свойств элементов-неметаллов в главных подгруппах, следует отметить, что сверху вниз с увеличением радиуса атома электроотрицательность, и соответственно окислительные свойства уменьшаются, т. е. уменьшается неметалличность элементов.
Физические свойства.
Элементы-неметаллы образуют простые вещества, которые при обычных условиях существуют в разных агрегатных состояниях:

7 элементов-неметаллов образуют простые вещества, существующие в виде двухатомных молекул Э2.
У неметаллов молекулярные и атомные кристаллические решетки. В связи с этим твердые вещества-неметаллы плохо проводят тепло и электричество, не обладают пластичностью.
Химические свойства.
Неметаллы как окислители
1.1. Окислительные свойства неметаллов проявляются в первую очередь при их взаимодействии с металлами.
1.2. Все неметаллы играют роль окислителя при взаимодействии с водородом.
1.3. Любой неметалл выступает в роли окислителя в реакциях с теми неметаллами, которые имеют более низкую ЭО. Например:
+5 -2
2Р° + 5S° = P2S5
В этой реакции сера — окислитель, а фосфор — восстановитель, так как ЭО фосфора меньше ЭО серы.
1.4. Окислительные свойства неметаллов проявляются в реакциях с некоторыми сложными веществами.
Здесь важно особо отметить окислительные свойства неметалла кислорода в реакциях окисления сложных веществ:
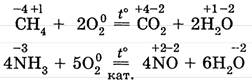
1.5. Не только кислород, но и другие неметаллы (фтор, хлор, бром и другие) также могут играть роль окислителя в реакциях со сложными веществами. Например, сильный окислитель С12 окисляет хлорид железа (II) в хлорид железа (III):
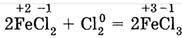
Разной окислительной активностью обусловлена способность одних неметаллов вытеснять другие из растворов их солей. Например, бром, как более сильный окислитель (ЭО (Вг) > ЭО (I)), вытесняет йод в свободном виде из раствора йодида калия: