Строение карбоновых кислот.
Карбоксильная группа состоит из С=О и ОН группы. На свойства кислоты влияют оба эти показателя. В группе С=О атом углерода обладает частично положительным зарядом и притягивает неподеленную пару атома кислорода из гидроксильной группы. При этом на кислороде электронная плотность понижается и связь О-Н ослабляется:

Группа ОН «нейтрализует» положительный заряд на группе С=О, которая перестает вступать в реакции присоединения, которые так характерны для карбонильных кислот.
Изомерия карбоновых кислот.
Для карбоновых кислот характерна изомерия углеродного скелета, положение кратной связи, межклассовая изомерия, пространственная изомерия и изомерия положения функциональной группы:

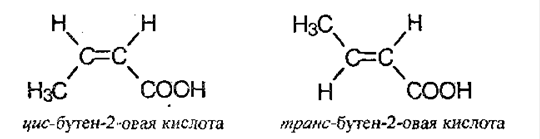
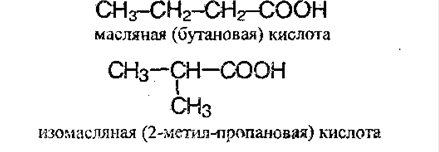

Физические свойства карбоновых кислот.
Общая формула кислот CnH2n+1COOH. Низшие кислоты в нормальных условиях представляют собой жидкости, которые обладают характерным запахом. Начиная с С10 – твердые вещества.
Твердые кислоты нерастворимы в воде, а кислоты с 1-3 количеством атомов углерода неограниченно смешиваются с водой.
Получение карбоновых кислот.
1. Окисление первичных спиртов перманганатом калия и дихроматом калия:
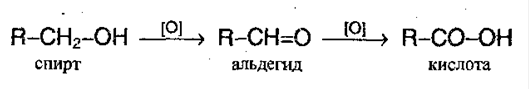
2. Гибролизгалогензамещенных углеводородов, содержащих 3 атома галогена у одного атома углерода:
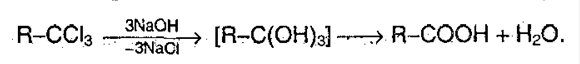
3. Получение карбоновых кислот из цианидов:
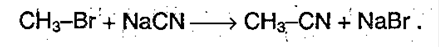
При нагревании нитрил гидролизуется с образованием ацетата аммония:
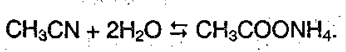
При подкисления которого выпадает кислота:

4. Использование реактивов Гриньяра:

5. Гидролиз сложных эфиров:
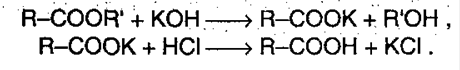
6. Гидролиз ангидридов кислот:

7. Специфические способы получения карбоновых кислот:
Муравьиная кислота получается при нагревании оксида углерода (II) с порошкообразным гидроксидом натрия под давлением:
 Уксусную кислоту получают каталитическим окислением бутана кислородом воздуха:
Уксусную кислоту получают каталитическим окислением бутана кислородом воздуха:

Бензойную кислоту получают окислением монозамещенных гомологов раствором перманганата калия:

Реакция Каннициаро. Бензальдегид обрабатывают 40-60% раствором гидроксида натрия при комнатной температуре.
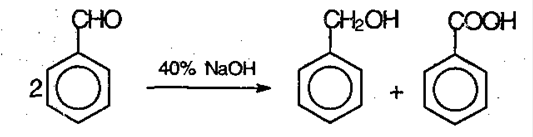
Химические свойства карбоновых кислот.
В водном растворе карбоновые кислоты диссоциируют:

Равновесие сдвинуто сильно влево, т.к. карбоновые кислоты являются слабыми.
Заместители влияют на кислотность вследствие индуктивного эффекта. Такие заместители оттягивают электронную плотность на себя и на них возникает отрицательный индуктивный эффект (-I). Оттягивание электронной плотности приводит к повышению кислотности кислоты. Электронодонорные заместители создают положительный индуктивный заряд.
1. Образование солей. Реагирование с основными оксидами, солями слабых кислот и активными металлами:

Карбоновые кислоты – слабые, т.к. минеральные кислоты вытесняют их из соответствующих солей:

2. Образование функциональных производных карбоновых кислот:


3. Сложные эфиры при нагревании кислоты со спиртом в присутствие серной кислоты – реакция этерификации:
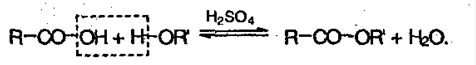
4. Образование амидов, нитрилов:



3. Свойства кислот обуславливаются наличием углеводородного радикала. Если протекает реакция в присутствие красного фосфора, то образует следующий продукт:
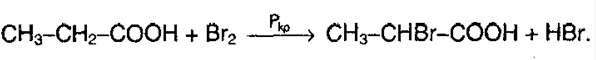
4. Реакция присоединения.
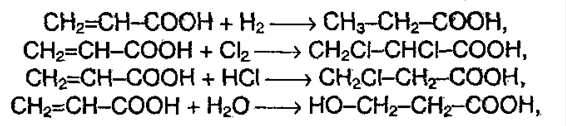 5. Окислительно-восстановительные реакции. При восстановлении в присутствие катализаторов:
5. Окислительно-восстановительные реакции. При восстановлении в присутствие катализаторов:

Исключение: муравьиная кислота:
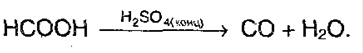
6. Реакция серебряного зеркала:


7. Окисляется хлором:
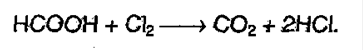
8. Декарбоксилирование. Реакцию проводят сплавлением щелочи с солью щелочного металла карбоновой кислоты:
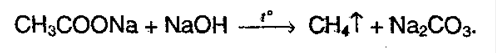
9. Двухосновная кислота легко отщепляет СО2 при нагревании:

Сложные эфиры – соединения, у которых атом водорода замещен углеводородным радикалом. Общая формула:

Изомерия сложных эфиров.
Для сложных эфиров характерны следующие виды изомерии: изомерия углеродной цепи, изомерия положения сложноэфирной группировки – СО-О-, межклассовая изомерия:


