Теоретический материал
Понятие «скорость химической реакции»
Скорость химической реакции характеризует, насколько превращение веществ протекает быстро или медленно. Изучением скоростей химических реакций занимается химическая кинетика. Одна из важнейших ее задач – управление скоростью реакции.
Для гомогенной реакции, протекающей в постоянном объеме, скорость реакции равна изменению концентрации любого из участвующих в реакции веществ в единицу времени:
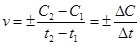
Если концентрация уменьшается (С2 < С1), то перед дробью ставят знак «минус», т. к. скорость не может иметь отрицательное значение.
Факторы, влияющие на скорость реакции
Природа реагирующих веществ
Например, металлы (натрий и калий) с одним и тем же веществом – водой – реагируют с различными скоростями. Калий очень энергично реагирует с водой, выделяющийся водород загорается на воздухе (рис. 2). Натрий реагирует с водой более спокойно (рис. 1).

Рис. 1. Взаимодействие натрия с водой

Рис. 2. Взаимодействие калия с водой
Концентрация исходных веществ
Чем больше концентрация веществ, тем больше вероятность столкновения реагирующих веществ, поэтому – тем больше скорость реакции.
Температура
Многие химические процессы ускоряются с ростом температуры. Например, мясо при комнатной температуре испортится гораздо скорее, чем в холодильнике; в странах с влажным тропическим климатом машины ржавеют быстрее, чем в северных широтах.
Например, если к раствору серной кислоты добавить немного черного порошка оксида меди (II), никаких изменений наблюдаться не будет. При нагревании же смеси раствор станет голубым.
Давление
Давление оказывает влияние на скорость реакции тогда, когда реакция протекает с участием газообразных веществ. С повышением давления скорость реакции возрастает. Это связано с тем, что с повышением давления расстояние между молекулами уменьшается, поэтому повышается вероятность столкновений молекул, приводящих к превращению вещества.
Площадь поверхности соприкосновения исходных веществ
Чем больше степень измельчения твердого вещества, тем больше площадь соприкосновения вещества с раствором. Это, в свою очередь, оказывает влияние на скорость реакции. Чем больше площадь поверхности соприкосновения реагирующих веществ, тем больше скорость реакции.
Присутствие катализатора
Скорость химических реакций может зависеть от присутствия некоторых веществ.
Вещества, которые ускоряют химическую реакцию, но сами в ней не расходуются, называют катализаторами.
Если перемешать порошок алюминия с порошком йода, то признаков реакции наблюдаться не будет. Реакция не идет. Но стоит добавить катализатор – капельку воды – как начинается бурная реакция. Вода, в данном случае, участвует в реакции, ускоряя превращение веществ, но сама в ней не расходуется.

Рис. 3. Взаимодействие алюминия с йодом в присутствии воды
Следует помнить, что один катализатор может ускорять одну реакцию, но не ускорять другую. Также существуют реакции, которые протекают быстро без катализатора. Такие реакции называют некаталитическими. Например, это реакции ионного обмена в растворах.
Химическое равновесие
Некоторые реакции при определенных условиях могут протекать как в прямом, так и в обратном направлении. Например, углекислый газ при взаимодействии с водой образует угольную кислоту, которая, в свою очередь, разлагается на углекислый газ и воду.
СО2 + Н2О ↔ Н2СО3
Такие реакции записывают со знаком обратимости и называют обратимыми.
Если в обратимой реакции скорости прямой и обратной реакции равны, то такое состояние называют химическим равновесием.
Вопросы для контроля:
1.Почему жидкий бензин и этанол горят спокойно, а пары этих веществ в смеси с воздухом взрываются?
2. Что такое катализатор? Каким образом катализатор изменяет скорость химической реакции?
Литература
1.О.С.Габриелян, «Химия -11», стр. 180- 187.
2.Хомченко И.Д. Сборник задач и упражнений по химии для средней школы. – М.: РИА «Новая волна»: Издатель Умеренков, 2008.
3.Энциклопедия для детей. Том 17. Химия / Глав. ред. В.А. Володин, вед. науч. ред. И. Леенсон. – М.: Аванта+, 2003. (с. 116–131)
4.https://interneturok.ru/lesson/chemistry/9-klass/bhimicheskaya-svyaz-elektroliticheskaya-dissociaciyab/skorost-himicheskih-reaktsiy-osnovnoy-urok