V теорет.
w = m практ.. 100%
M. теорет.
Далее вместе с учениками разбирается несколько примеров решения задач на выход продукта химической реакции:
Пример 1: Задача 1. Вычислите массу карбида кальция, образовавшегося при действии угля на оксид кальция массой 16,8 г, если выход составляет 80%.
Алгоритм решения задач.
1.Запишем Дано:
m(CaO) = 16,8 г
· =80% или 0,8
Найти: m практ. (CaC2) =?
2. Запишем УХР. Расставим коэффициенты. СаO + 3C = CaC2 + CO
Над формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции.
16,8 г х(пр) г
СаO + 3C = CaC2 + CO
3. Находим по ПСХЭ молярные массы веществ
M(CaO) = 40 + 16 = 56 г/моль
M(CaC2) = 40 + 2 · 12 = 64г/моль
1 вариант решения (через моли).
- Находим количество вещества реагента по формулам:
n=m/M
n(CaO)=16,8 (г) / 56 (г/моль) = 0,3 моль
- По УХР вычисляем теоретическое количество вещества (νтеор)
n(CaO)= n(CaC2)= 0,3 моль
теоретическую массу (mтеор) продукта реакции
m=n*M; m(CaC2)=0,3 моль*64 г/моль= 19,2 г
2. вариант решения (через пропорцию).
4. Составляем по УХР пропорцию
16,8г х (теор.)г
56 г/моль = 64г/моль
Отсюда х= 16,8г*64г/моль/56г/моль=19,2 г
6. Находим массовую (объёмную) долю выхода продукта поформуле:
7.
m практич (CaC2) = 0,8 · 19,2 г = 15,36 г
Ответ: m практич (CaC2) = 15,36 г
VI. Закрепление пройденного материала.
Закрепление пройденного материала: решение задач на доске, и индивидуальные карточки с заданиями разной сложности.
Демонстрационный опыт:
В мерный стакан наливаем раствор хлорида меди, добавляем избыток раствора гидроксида калия. Наблюдаем выпадения гидроксида меди II, в виде синего осадка.
2 задача. К раствору, содержащему 27 г хлорида меди (II), прибавили избыток гидроксида калия. При этом выпал осадок гидроксида меди (II), массой 19 г, определите выход продукта реакции (в процентах).
(Слайд 10)
Д а н о: Решение:
m(CuCL2) = 27 г СuCl2 + 2KOH = Cu(OH)2 + 2KCl
m практ. (Cu(OH)2)=19г
w=?
M(CuCl2) = 64 +35.5*2 = 135 г/моль
M(Cu(OH)2) = 64 + 2 · 16 +2 = 98г/моль
ν(CuCl2)=27 (г) /135 (г/моль) = 0,2 моль
0.2 моль CuCl2 = 0,2 моль Cu(OH)2
m теор (CuCl2)= 0.2 моль*98 (г/моль)= 19.6 г
19*100/19,6= 96,9%
Ответ: w= 96,9%
Алгоритм решения задач на практический выход
| Последовательность действий | Пример выполнения действий |
| 1.Запишите условие и требование задачи с помощью общепринятых обозначений | Дано: m(НNО3)=252 г ᶮ(соли)=90% Найти: m(соли)-? |
| 2.Составьте уравнение химической реакции. Рассчитайте массу соли по уравнению – это теоретическая масса соли | Решение: NаОН + НNO3 = NаNO3+Н2О |
| 3.В уравнении подчеркните формулы веществ, которые записаны в «Дано» и «Найти» | NаОН + НNO3 = NаNO3 +Н2О |
| 5.Под подчеркнутыми формулами подпишите по коэффициентам число моль | NаОН + НNO3 = NаNO3 +Н2О 1 моль 1 моль |
| 6.Вычислите количество вещества n, которое записано в «Дано». | 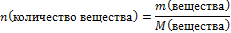 n(НNO3) =
n(НNO3) = 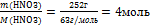
|
| 7.Подпишите найденное n под формулой этого вещества | NаОН + НNO3 = NаNO3 +Н2О 1 моль 1 моль 4 моль |
| 8.Под формулой вещества, массу которого надо найти, поставьте х моль | NаОН + НNO3 = NаNO3 +Н2О 1 моль 1 моль 4 моль х моль |
| 9.Из полученной пропорции выразите х | 1 моль 1 моль
4 моль х моль
х = 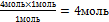 –
это количество вещества n(NаNO3) –
это количество вещества n(NаNO3)
|
| 10.Зная n(NаNO3) найдите массу NаNO3 | m=nM
m (NаNO3)= n (NаNO3) 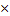 M (NаNO3)
M (NаNO3=23+ 14+16 M (NаNO3)
M (NаNO3=23+ 14+16 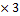 =85г/моль
m(NаNO3)=4 =85г/моль
m(NаNO3)=4 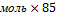 г/моль=340г – теоретическая масса соли г/моль=340г – теоретическая масса соли
|
| 11.Вычислите практическую массу полученной соли | 340 г - 100%
Х г - 90%
х = 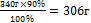 - практическая масса NаNO3 - практическая масса NаNO3
|
| 11.Запишите ответ | Ответ: m (NаNO3) =306 г |
Самостоятельная работа
Задача 1. Определите выход продукта реакции синтеза аммиака, если при взаимодействии 6,72 л азота с избытком водорода получено 6,72 л аммиака.
Задача 2. Определите массу карбоната кальция, необходимую для получения
7 л углекислого газа реакцией разложения, если его выход составляет 0,8 (80%).
Задача 3. При разложении 200 г известняка (карбоната кальция) было
получено 100 г оксида кальция. Определите массовую долю выхода реакции.
Задача 4. При разложении карбоната кальция образовалось 50 г оксида
кальция, что составляет 80 % от теоретического выхода. Сколько граммов
карбоната кальция подвергли разложению?