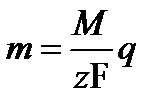
 Вещества, проводящие ток и при этом разлагающиеся, называют проводниками второго рода или электролитами, а сам процесс разделения их электрическим током – электролизом. К электролитам относятся растворы кислот, щелочей и солей. Электролитической проводимостью обладают и расплавленные соли. При электролитической проводимости носителями тока являются ионы. В электролитических растворах расщепление молекул на ионы производится действием растворителя – электролитическая диссоциация. Нейтрализация ионов на поверхности электродов – необходимое звено в прохождении тока через гальваническую цепь. Прямым следствием процесса электролиза является накопление у электродов продуктов химического разложения электролита. Первый закон Фарадея: при электролизе за время t на электродах выделяются количества вещества m, пропорциональные количеству электричества q, прошедшего за то же время через электролит: m = kq. k – коэффициент пропорцио –нальности. Второй закон Фарадея: при прохождении тока последовательно через несколько электролитов количества веществ, выделяющихся за некоторый промежуток времени t в разных электролитах, пропорциональны так называемым химическим эквивалентам этих веществ.
Вещества, проводящие ток и при этом разлагающиеся, называют проводниками второго рода или электролитами, а сам процесс разделения их электрическим током – электролизом. К электролитам относятся растворы кислот, щелочей и солей. Электролитической проводимостью обладают и расплавленные соли. При электролитической проводимости носителями тока являются ионы. В электролитических растворах расщепление молекул на ионы производится действием растворителя – электролитическая диссоциация. Нейтрализация ионов на поверхности электродов – необходимое звено в прохождении тока через гальваническую цепь. Прямым следствием процесса электролиза является накопление у электродов продуктов химического разложения электролита. Первый закон Фарадея: при электролизе за время t на электродах выделяются количества вещества m, пропорциональные количеству электричества q, прошедшего за то же время через электролит: m = kq. k – коэффициент пропорцио –нальности. Второй закон Фарадея: при прохождении тока последовательно через несколько электролитов количества веществ, выделяющихся за некоторый промежуток времени t в разных электролитах, пропорциональны так называемым химическим эквивалентам этих веществ.
Соединяя оба закона Фарадея: численноF=96485Кл.
электролиз каждой соли начинается с определенного, характерного для нее напряжения (потенциал разложения); если напряжение будет ниже, постоянный ток вообще не будет проходить через раствор. Раствор, содержащий 1 химический эквивалент в литре, называют нормальным раствором электролита.
Топливный элемент
 (ТЭ) - электрохимический генератор, устройство, обеспечивающее прямое преобразование химической энергии в электрическую. Топливные элементы имеют два важных отличия:1) они функционируют до тех пор, пока топливо и окислитель поступают из внешнего источника;2) химический состав электролита в процессе работы не изменяется, т.е. топливный элемент не нуждается в перезарядке. Принцип действия: Топливный элемент состоит из двух электродов, разделенных электролитом, и систем подвода топлива на один электрод и окислителя на другой, а также системы для удаления продуктов реакции. При этом происходит разложение молекул водорода на атомы, которые в результате хемосорбции отдают свои электроны и превращаются в положительно заряженные ионы. Этот процесс может быть описан следующими уравнениями:
(ТЭ) - электрохимический генератор, устройство, обеспечивающее прямое преобразование химической энергии в электрическую. Топливные элементы имеют два важных отличия:1) они функционируют до тех пор, пока топливо и окислитель поступают из внешнего источника;2) химический состав электролита в процессе работы не изменяется, т.е. топливный элемент не нуждается в перезарядке. Принцип действия: Топливный элемент состоит из двух электродов, разделенных электролитом, и систем подвода топлива на один электрод и окислителя на другой, а также системы для удаления продуктов реакции. При этом происходит разложение молекул водорода на атомы, которые в результате хемосорбции отдают свои электроны и превращаются в положительно заряженные ионы. Этот процесс может быть описан следующими уравнениями:
|
|
2Н2 4Н 4Н 4Н+ +4е-
 Подаваемый на катод кислород переходит в электролит и также реагирует на поверхности электрода с участием катализатора (обычно Pt). При соединении его с ионами водорода и электронами, которые поступают из внешней цепи, образуется вода: О2 +4Н+ + 4е- 2Н2О Поток электронов и ионов поддерживает баланс заряда и вещества в электролите. Образующаяся в результате реакции вода частично разбавляет электролит. В таких элементах наряду с кислородом используется воздух. Образующаяся при работе вода не растворяет электролит и может быть легко удалена.
Подаваемый на катод кислород переходит в электролит и также реагирует на поверхности электрода с участием катализатора (обычно Pt). При соединении его с ионами водорода и электронами, которые поступают из внешней цепи, образуется вода: О2 +4Н+ + 4е- 2Н2О Поток электронов и ионов поддерживает баланс заряда и вещества в электролите. Образующаяся в результате реакции вода частично разбавляет электролит. В таких элементах наряду с кислородом используется воздух. Образующаяся при работе вода не растворяет электролит и может быть легко удалена.