Тема 1.7. Коррозия металлов. Защита металлов от коррозии.
Вопросы по ранее изученной теме:
- Как меняется восстановительная активность металлов в электрохимическом ряду напряжений?
- Почему в ряду активности вместе с металлами находится и водород?
- На какие две группы водород разделяет все металлы?
- Определите, к какому типу относятся реакции, характеризующие свойства металлов? Обоснуйте ответ.
- Как по положению металла в ряду активности (РА) можно сделать вывод о его отношении к кислотам, воде, солям и кислороду воздуха?
- Почему при взаимодействии с водой металлов средней активности образуются их оксиды, а не гидроксиды?
- Укажите наиболее распространенные способы получения металлов.
- Почему в природе не встречаются самородки щелочных и щелочноземельных металлов?
- Щелочные и щелочноземельные металлы получают электролизом расплавов их солей. Почему эти металлы нельзя получить электролизом растворов солей? Что является в таких реакциях восстановителем?
- Что такое сплавы как их классифицируют?
- Охарактеризуйте состав и свойства чугунов, важнейших легированных сталей и области их применения.
- Назовите важнейшие сплавы цветных металлов, примерный их состав, свойства и применение.
Коррозией называется разрушение металлов под влиянием окружающей среды в результате химического или электрохимического взаимодействия с ней.
Различают два вида коррозии: химическую и электрохимическую.
Химическая коррозия обусловливается взаимодействием металлов с сухими газами или жидкостями, не являющимися электролитами.
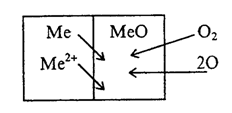 |
Механизм химической коррозии сводится к диффузии атомов или ионов металлов сквозь постепенно уплотняющуюся пленку продуктов коррозии и встречной диффузии атомов или ионов кислорода (химическое окисление):
Примером газовой коррозии является взаимодействие металлов при высокой температуре с кислородом и другими газообразными активными средами: Н2S, SО2, галогенами, СО2 и др.
Электрохимическая коррозия - разрушение металла при контакте двух разнородных металлов в присутствии электролита.
Механизм электрохимической коррозии основан на общих законах коррозионных гальванических элементов.
Кратко рассмотрим принцип действия гальванического элемента.
Гальванические элементы - это приборы, вырабатывающие электрический ток в результате окислительно-восстановительных процессов, происходящих на электродах, которые состоят из металлов, разных по химической активности.
Как уже было сказано, в кристаллической структуре металлов существует равновесие между атомами металла, ионами и электронами:
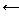 Me → Men+ + n e ˉ
Me → Men+ + n e ˉ
и металлические свойства выражены тем сильнее, чем больше концентрация свободных электронов.
При опускании металла в воду или в раствор собственной солей (под действием полярных молекул воды или соответственно аниона) часть ионов металла переходит в жидкость. В результате такого перехода жидкость в непосредственной близости к металлу заряжается положительно, металл - отрицательно.
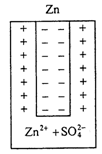 Благодаря отрицательному заряду на металле к нему будут притягиваться перешедшие в раствор положительно заряженные ионы. В результате наступает динамическое равновесие. Возникает двойной электрический слой между металлом и окружающей средой, в результате устанавливается разность потенциалов, которая называется электродным потенциалом металла
Благодаря отрицательному заряду на металле к нему будут притягиваться перешедшие в раствор положительно заряженные ионы. В результате наступает динамическое равновесие. Возникает двойной электрический слой между металлом и окружающей средой, в результате устанавливается разность потенциалов, которая называется электродным потенциалом металла
Возникновение электрического тока в гальваническом элементе связано с различной концентрацией свободных электронов в металлах, стремлением к ее выравниванию при контакте между ними.
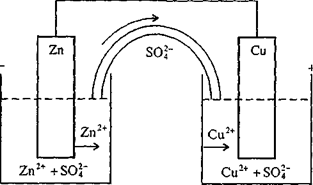
Электрод, отдающий электроны (окисление), называется анодом, принимающий (восстановление) - катодом.
Анодом является более активный металл. Анод, как правило, разрушается (так как электроны перетекают к катоду, а ионы уходят в раствор).
(‒) Zn / ZnSO4│CuSO4 / Cu (+)
Процессы в гальванических элементах принято записывать в виде схем. Например:
на электроде из цинка (аноде), погруженном в раствор соли ZnSО4, происходит процесс окисления:
Zn - 2 e ‾ = Zn2+
на электроде из меди (катоде), погруженном в раствор соли CuSО4, происходит процесс восстановления:
Cu2+ + 2 e ‾ = Cu0
Одновременно часть ионов SО42‾ переходит по электрическому мостику в сосуд с раствором ZnSO4.
Необходимо обратить внимание на то, что у гальванических элементов отрицательный электрод называется анодом, положительный - катодом. В случае электролиза название электродов обратное: отрицательный электрод называется катодом (соединен с отрицательным полюсом), положительный - анодом (соединен с положительным полюсом).
Название электрода обусловлено процессом, протекающем на нем (на катоде - восстановление, на аноде - окисление).
При работе гальванической пары коррозирует (разрушается) боле активный металл.
Рассмотрим примеры электрохимической коррозии.
При действии серной кислоты на технический цинк, содержащий примесь железа, на поверхности цинка возникает множество микрогальванических элементов:
Zn / H2SO4 / H2 / Fe
Анодом в этом элементе будет цинк, катодом - железо. На аноде протекает процесс:
Zn - 2 ē = Zn2+ (окисление)
на катоде:
2Н+ + 2 ē = 2Н = Н2 (восстановление)
Рассмотренный пример относится к коррозии в кислой среде. По другому протекает процесс коррозии в нейтральной среде.
Окислителем в нейтральной среде будут уже не ионы водорода, а молекулы кислорода, растворенного в воде, которые на катоде превращаются в ионы ОН¯. Например, при коррозии технического железа во влажном воздухе протекают следующие реакции:
на аноде:
2Fе - 4 ē ~ 2Fе2+ (продуктом реакции является гидроксид железа (II)),
на катоде:
О2 + 2Н2О + 4 ē = 4ОН¯
Гидроксид железа (II) в присутствии воды и кислорода воздуха переходит в гидроксид железа (III):
4Fе(ОН)2 + О2 + 2Н2О = 4Fе(ОН)3
Причиной электрохимической коррозии являются главным образом загрязнения, примеси, содержащиеся в металле, или неоднородность его поверхности. Электролитом может быть влажный воздух, в котором есть различные растворенные газы - СО2, SО2 и др.
Наличие электрогальванических пар и электролита обусловливают образование гальванических элементов. Анодом являются частицы металла, катодом - загрязнения, примеси. На катоде идет разрядка ионов водорода или протекает процесс восстановления кислорода, растворенного в электролите (в зависимости от рН среды электролита). Анод разрушается.
Коррозия приносит большой вред народному хозяйству: теряется большое количество металла, портятся и выходят из строя металлические конструкции, поэтому вопросам защиты металлов от коррозии придается огромное значение.
Способы защиты от коррозии многообразны. Основные из них следующие:
a) нанесение защитных покрытий;
b) изменение состава среды;
c) применение электрохимических методов;
d) применение сплавов.
Основной метод борьбы с коррозией - это изоляция металла от агрессивной среды с помощью различных покрытий. Большое распространение получили неметаллические покрытия: лаки, краски, эмали, пленки. Часто металл покрывают другими металлами, более коррозионно-стойкими. При нарушении покрытия обнажается часть защищаемого металла, и он вступает в контакт с внешней средой. Это вызывает коррозию вследствие образования гальванического элемента. Причем разрушаться будет более активный металл.
 |
На рисунке показана коррозия оцинкованного железа.
 |
Так как цинк более активный металл и является в данном гальваническом элементе анодом, то он будет разрушаться, а железо будет сохраняться до тех пор, пока не разрушится весь защитный слой цинка. Покрытие более активным металлом называется анодным. Металлы менее активные, чем защищаемые металлы, образуют катодные покрытия. Так, олово, нанесенное на железо, образует катодное покрытие (луженое железо). При нарушении защитного слоя будет подергаться коррозии само железо, так как железо в данном случае является анодом, а олово – катодом.
Применяется противокоррозийная защита, основанная на химическом изменении поверхности металла: оксидирование, анодирование, воронение, фосфатирование.
Имеет место и такой метод защиты металлов от коррозии, как изменение состава среды. Он заключается в удалении вредных примесей из окружающей металл среды. Например, удаление солей и кислород из воды, используемой в паровых котлах.
Широко применяются электрохимические методы защиты от коррозии. Различают катодную защиту и протекторную.
Катодная защита состоит в том, что вся поверхность сооружении искусственно делается катодом (присоединение к катоду внешне источника тока).
Протекторная защита состоит в том, что к защищаемой металлической конструкции прикрепляют кусок или пластинку более активного металла (этот металл разрушается, защищая конструкцию). Эти методом защищают днища кораблей, трубы, кабели.
И, наконец, многие сплавы обладают значительной стойкостью против коррозии (сплавы с хромом, молибденом, никелем).
Вопросы и задания
- Какие существуют способы защиты металлов от коррозии?
- Объясните принцип действия гальванического элемента.
- Как протекает коррозия луженого железа (покрытого оловом), когда слой олова поврежден?
- В чем сущность протекторной защиты металлов от коррозии?
- Почему железо подвергается коррозии во влажном воздухе? Чем отличается коррозия железа в кислой среде от коррозии в нейтральной?
- Анодным или катодным покрытием является никель для цинка, серебра? В чем сущность электрохимической коррозии?
Литература: 1,3.