Получение оксида углерода (IV) и изучение его свойств.
Распознавание карбонатов
Цель: научить получать углекислый газ реакцией обмена; продолжить ознакомление с химическими свойствами углекислого газа; познакомить с методами распознавания карбонатов.
Оборудование и реактивы: кусочки мрамора, фенолфталеин, лакмус, растворы: соляной кислоты и гидроксида натрия, известковая вода, в пронумерованных пробирках кристаллические вещества: сульфат натрия, хлорид цинка, карбонат калия, силикат натрия; раствор нитрата серебра, вода, пробирки, газоотводная трубка с пробкой, стакан.
Техника безопасности: осторожное обращение с химреактивами и стеклянной посудой.
1. Прочитайте инструкцию по выполнению работы:
Получение оксида углерода (IV) и изучение его свойств.
1. Поместите в пробирку несколько кусочков мела или мрамора и прилейте немного разбавленной соляной кислоты.
2. Пробирку быстро закройте пробкой с газоотводной трубкой. Конец трубки поместите в другую пробирку, в которой находится 2—3 мл известковой воды.
3. Несколько минут продолжайте пропускать газ.
4. Конец газоотводной трубки выньте из раствора и сполосните его в дистиллированной воде. Затем поместите трубку в пробирку с 2—3 мл дистиллированной воды и пропустите через нее газ. Через несколько минут выньте трубку из раствора, добавьте к полученному раствору несколько капель раствора синего лакмуса.
5. В пробирку налейте 2—3 мл разбавленного раствора гидроксида натрия и добавьте к нему несколько капель фенолфталеина. Затем через раствор пропустите газ.
Задания. 1. Что происходит, если на мел или мрамор подействуют соляной кислотой?
2. Почему при пропускании газа через раствор известковой воды сначала происходит помутнение, а затем взвесь растворяется?
3. Что происходит при пропускании оксида углерода(IV) через дистиллированную воду?
4. Напишите уравнения соответствующих реакций в молекулярном, ионном и сокращенном ионном виде.
2.Распознавание карбонатов.
В четырех пробирках даны кристаллические вещества: сульфат натрия, хлорид цинка, карбонат калия, силикат натрия. Определите, какое вещество находится в каждой пробирке.
Задания. 1. На основе выполненных опытов сделайте вывод, что является характерной качественной реакцией на карбонат-ион.
2. Составьте уравнения реакций в молекулярном, ионном и сокращенном ионном виде.
2. Посмотрите видеофрагмент по выполнению работы:
1. Получение и собирание СО2. - https://www.youtube.com/watch?v=fo_zYHDRx1M
2.Распознавание карбонатов - https://www.youtube.com/watch?v=anbSnBbal5o
II. В тетради оформляем работу поэтапно с рисунками.
Тема: Практическая работа №6.
Получение оксида углерода (IV) и изучение его свойств.
Распознавание карбонатов
Цель: научить получать углекислый газ реакцией обмена; продолжить ознакомление с химическими свойствами углекислого газа; познакомить с методами распознавания карбонатов.
С правилами техники безопасности ознакомлен (а):_____________
Оборудование и реактивы: кусочки мрамора, фенолфталеин, лакмус, растворы: соляной кислоты и гидроксида натрия, известковая вода, в пронумерованных пробирках кристаллические вещества: сульфат натрия, хлорид цинка, карбонат калия, силикат натрия; раствор нитрата серебра, вода, пробирки, газоотводная трубка с пробкой, стакан.
Ход работы:
| Что делали | Что наблюдали | Вывод |
| Получение оксида углерода (IV) и определение его свойств | ||
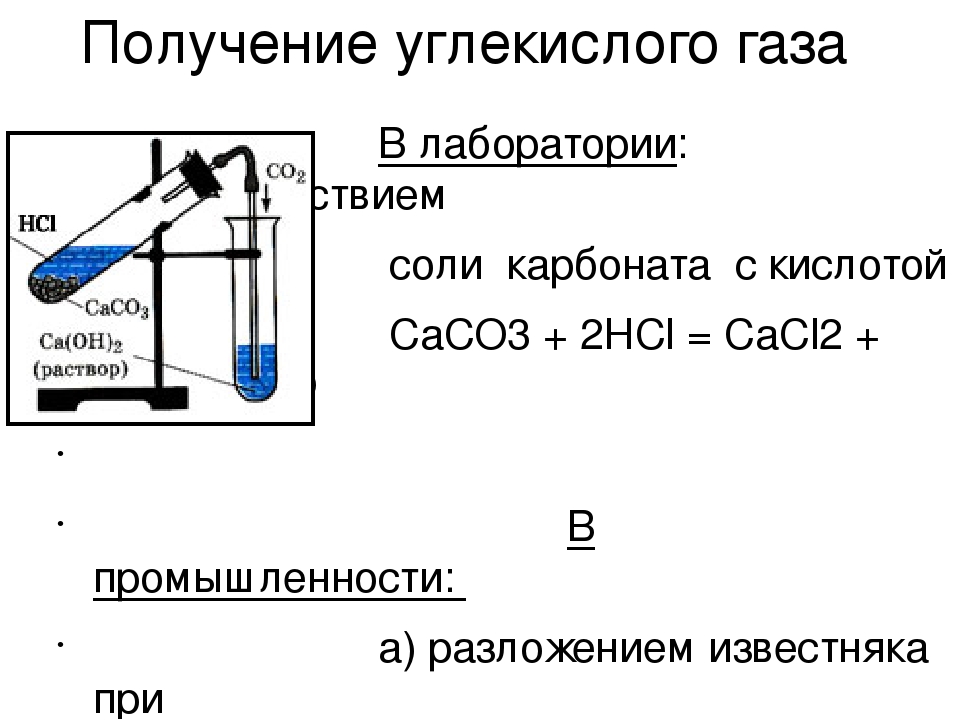 В пробирку поместим кусочек
Мрамора и прильем раствор соляной кислоты и закроем пробкой с газоотводной трубкой
В пробирку поместим кусочек
Мрамора и прильем раствор соляной кислоты и закроем пробкой с газоотводной трубкой
| Выделение газа: CaCO3 + HCl= CaCl2 +CO2+H2O | При воздействии соляной кислоты на мрамор выделяется ….? (дописать!!!) |
| Пропускаем газ через раствор известковой воды: | Помутнение раствора: CO2 + Ca(OH)2= CaCO3 + H2O | ? |
| Пропускаем углекислый газ еще некоторое время | Раствор становится прозрачным | Карбонат кальция растворяется под воздействием оксида углерода (IV) и образуется кислая соль гидрокарбонат: CaCO3 + CO2 + H2O = Ca(HCO3)2 |
| Пропускаем углекислый газ через дистиллированную воду подкрашенную синим лакмусом: CO2 + H2O = | Лакмус краснеет | В воде образуется слабая угольная кислота: H2CO3= CO2 + H2O |
| Пропускаем углекислый газ через раствор гидроксида натрия с фенолфталеином: CO2 + NaOH = | Малиновая окраска исчезает, раствор становится прозрачным | Реакция нейтрализации: CO2 +2NaOH = Na2CO3+ H2O |
| Распознавание карбонатов | ||
| Даны вещества: 1) Na2SO4,2)K2CO3, 3)Na2SiO3, найти среди предложенных веществ карбонат | ||
| В каждую из пробирок добавляем раствор соляной кислоты Na2SO4 + HCl = K2CO3+ HCl = Na2SiO3 + HCl = | В 1й пробирке ничего не измени- лось, в одной из пробирок выделил- ся газ, в другой студенистый осадок | Выделение газа при действии кислоты - признак карбонатов: K2CO3+ HCl = KCl + H2O + CO2 Студенистый осадок – образовалась нерастворимая кремниевая кислота: Na2SiO3+ HCl = 2NaCl + H2SiO3 |
| В оставшуюся пробирку добавляем по каплям раствор нитрата серебра: Na2SO4 + AgNO3 = | Выпал желтый осадок | Na2SO4 + AgNO3= Ag2SO4 + NaNO3 |
| Вывод: (дописываем вывод по работе!!!) ______________________________ ___________________________________________________________________ ___________________________________________________________________ ___________________________________________________________________ |
1. Домашнее задание. П.36, упр 3,5 с.128-129.
Обратная связь
Выполнить практическую работу и выслать ЛС в ВК
до 15.00 ч 22.02.2022.
Домашнюю работу не позднее субботы 26.02.22