Краткие теоретические и учебно-методические материалы по теме практического занятия
1. Относительная молекулярная масса равна сумме всех относительных атомных масс элементов с учетом индекса элемента. Относительная молекулярная масса соединения величина безразмерная. Она показывает во сколько раз относительная молекулярная масса соединения больше 1/12 массы изотопа углерода-12.
2. Для вычисления относительной молекулярной массы необходимо суммировать относительные атомные массы элементов образующих соединение.
Мr = n1 *Аr1 + n2* Ar2 + n3* Ar3 (1)
3. Зная относительные атомные массы элементов и число атомов, входящих в состав химического соединения, можно определить массовые соотношения этих элементов.
4. Массовая доля элемента в данном веществе (w) – отношение относительной атомной массы данного элемента, умноженной на число его атомов в молекуле к относительной молекулярной массе вещества:
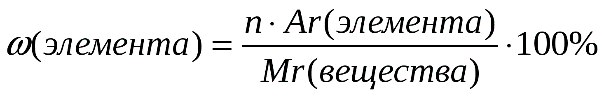 (2)
(2)
где w – массовая доля элемента в веществе;
Ar– относительная атомная масса;
n– индекс в химической формуле;
Mr– относительная молекулярная масса вещества.
Массовые доли выражают в процентах или в долях:
w (элемента) = 20% или 0,2.
5. Молярная масса вещества (M) – масса, которую имеет 1 моль данного вещества.
Эта величина, равная отношению массы m вещества к количеству вещества ν, имеет размерность кг/моль или г/моль. Молярная масса, выраженная в г/моль, численно равна относительной молекулярной массе Mr (для веществ атомного строения – относительной атомной массе Ar).
Молярную массу вещества можно вычислить, если известны его масса m и количество (число молей) ν, по формуле:
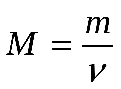 (3)
(3)
Соответственно, зная массу и молярную массу вещества, можно рассчитать число его молей:
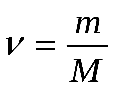 (4)
(4)
или найти массу вещества по числу молей и молярной массе:
m = ν • M (5)
Необходимо отметить, что значение молярной массы вещества определяется его качественным и количественным составом, т.е. зависит от Mr и Ar. Поэтому разные вещества при одинаковом количестве молей имеют различные массы m.
6. Задачи на вывод формулы вещества по данным химического анализа относится к группе задач, которые решаются по формулам.
Для решения задач данного типа необходимо знать массовые доли элементов, которые входят в состав соединения.
Также необходимо знать, что общее содержание веществ в соединении равно 100%. Поэтому иногда в условии задачи указывается содержание не всех элементов, с учетом того, что неизвестное содержание второго или третьего элемента всегда можно определить.
Вопросы для закрепления теоретического материала к практическому занятию
- Сформулируйте закон постоянства состава и закон сохранения массы вещества.
- Кем и когда был сформулирован закон сохранения массы вещества?
- Кем и когда был сформулирован закон постоянства состава?
Задания для практического занятия:
- Решить предложенные задачи.
- Правильно оформить их в тетрадь для практических и контрольных работ.
- Ответить на вопросы для контроля.
- Отчитаться о выполненной работе преподавателю.
Задание 1
| Определить массовую долю в процентах азота в соединениях (с точностью до сотых): | |
| Вариант 1 | Вариант 2 |
| HNO3, N2O | N2O5, NH4OH |
Образец решения задания № 1
Вычислите массовую долю кислорода в ортофосфорной кислоте, имеющей простейшую химическую формулу H3PO4, с точностью до сотых.
Алгоритм решения
Дано: Ортофосфорная кислота H3PO4
Найти: w (О) -?
Решение
1. Из Периодической таблицы Д.И. Менделеева выписываем значения относительных масс атомов элементов, входящих в состав ортофосфорной кислоты:
Ar(H) = 1 а.е.м., Ar(P) = 31 а.е.м., Ar(O) = 16 а.е.м
2. Записываем формулу расчета в общем виде Mr(H3PO4):
Mr(H3PO4) = n1*Ar(H) + n2*Ar(P) + n3*Ar(O)
3. Подставляем значения относительных атомных масс элементов с учетом моль атомов в формулу расчета и вычисляем:
Mr(H3PO4) = 3·Ar(H) + Ar(P) + 4·Ar(O) = 3·1 + 31 + 4·16 = 98 а.е.м
4. Вычисляем массовую долю элементов по формуле (2):
w(O) = n(O)·Ar(O)·100% / Mr(H3PO4) = 4·16·100% / 98 = 65,31%.
Ответ: w(O) = 65,31%.
Задание 2
| Вариант 1 | Вариант 2 |
| Выведите простейшую формулу вещества, содержащего Na (массовая доля 43,2%), С (11,3%), О (45,5%). | Найдите простейшую формулу гипосульфита натрия, если состав этого соединения следующий: Na (массовая доля 29,1%), S (40,5%), O (30,4%). |