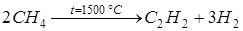ДИЕНОВЫЕ УГЛЕВОДOPOДЫ.
Диеновыми углеводородами (алкадиенами) называют углеводороды с открытыми углеродными цепями, в молекулах которых содержатся две двойные связи.
Они имеют общую формулу СnH2n-2 и классифицируются по принципу взаимного расположения двойных связей:
1. Соединения с изолированными двойными связями, например
СН2=СН−СН2−СН=СН2
пентадиен-1,4
В этих соединениях двойные связи находятся достаточно далеко друг от друга и не оказывают взаимного влияния. Свойства диенов с изолированными двойными связями аналогичны свойствам алкенов:
 СН2=СН−СН2−СН=СН2 + 2 HBr СН3−СНBr−СН2−СНBr−СН3
СН2=СН−СН2−СН=СН2 + 2 HBr СН3−СНBr−СН2−СНBr−СН3
2,4-дибромпентан
2. Соединения с кумулированными двойными связями (1,2-диены). Такие соединения называют алленами.
Простейший представитель алленов − пропандиен-1,2: СН2=С=СН2. Аллены менее стабильны, чем другие представители диенов. Для них также характерны реакции присоединения по двойной связи.
3. Соединения с сопряженными двойными связями (1,3-диены), в которых двойные связи разделены одной простой. Представители этой группы:
СН2=СН−СН=СН2 СН2=С (CH3) − СН=СН2
бутадиен -1,3 (дивинил) 2-метилбутадиен-1,3 (изопрен)
Электронное строение сопряженных диенов
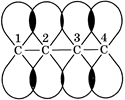 Атомы углерода, образующие двойные связи, находятся в sp2-гибридном состоянии и, следовательно, имеют по одной негибридной p-орбитали, которые в 1,3-диенах перекрываются не только у первого и второго, третьего и четвертого углеродных атомов, но вследствие пространственного расположения также у второго и третьего углеродных атомов, образуя общее для всех углеродных атомов π-электронное облако (рис. 1). Такое взаимодействие двух соседних π-связей называется сопряжением.
Атомы углерода, образующие двойные связи, находятся в sp2-гибридном состоянии и, следовательно, имеют по одной негибридной p-орбитали, которые в 1,3-диенах перекрываются не только у первого и второго, третьего и четвертого углеродных атомов, но вследствие пространственного расположения также у второго и третьего углеродных атомов, образуя общее для всех углеродных атомов π-электронное облако (рис. 1). Такое взаимодействие двух соседних π-связей называется сопряжением.
Рис. 1. Перекрывание орбиталей (сопряжение) в молекуле бутадиена-1,3
Номенклатура алкадиенов.

Упражнение.
Составить формулы по названиям:
1. 2-метилгексадиен-1, 5
2. 2, 4-диметилпентадиен-2, 4
3. 2, 2, 6-триметил-4-этилгептен-3
Химические свойства сопряженных диенов
Реакции присоединения по двойным связям 1,3-диенов протекают значительно легче, чем для большинства алкенов. При этом получаются продукты как 1,2-, так и 1,4- присоединения:
1,2-присоединение

 1 2 3 4 СН3−СНBr−СН=СН2
1 2 3 4 СН3−СНBr−СН=СН2
 СН2=СН−СН=СН2 + HBr 3-бромбутен-1
СН2=СН−СН=СН2 + HBr 3-бромбутен-1
 СН3−СН=СН−СН2Br
СН3−СН=СН−СН2Br
1,4-присоединение
1-бромбутен-2
Особенности реакций присоединения к алкадиенам.
В процессе присоединения на первой стадии у диеновых углеводородов разрываются обе двойные связи, образуется двойная связь посредине молекулы, а присоединение атомов других элементов происходит по концам молекулы в положениях 1,4 (в большинстве случаев в смеси преобладает продукт 1,4-присоединения; его образование обусловлено участием в реакции сопряженной электронной системы). Обесцвечивают раствор бромной воды (Br2) и перманганата калия (KMnO4)
КАУЧУК.
Каучуками называют продукты полимеризации диеновых углеводородов и их производных.
Природный, или натуральный, каучук получают из млечного сока (латекса) каучуконосных растений, например гевеи.

Каучуки относят к полимерам, называемым эластомерами. Однако каучуки очень чувствительны к высоким и низким температурам. Этот недостаток устраняется с помощью процесса, называемого вулканизацией. Он заключается в нагревании каучука с серой, при этом отдельные полимерные цепи сшиваются между собой за счет образования дисульфидных мостиков.
Продукт частичной вулканизации каучука называют резиной. Она имеет сетчатую структуру и менее эластична, чем каучук, но обладает значительно большей прочностью. При увеличении количества серы (до 30%) продукт вулканизации (эбонит) полностью теряет пластичность.
Синтетические каучуки.
Первый синтетический каучук был получен в СССР под руководством академика С.В. Лебедева в 1932 году, радикальной полимеризацией бутадиена-1,3 в присутствии металлического натрия.
Бутадиеновый каучук обладает хорошей водо- и газонепроницаемостью, но менее эластичен, чем натуральный каучук.
Общим недостатком углеводородных каучуков является их низкая термическая устойчивость, набухание и разрушение в нефтепродуктах, этих недостатков лишен хлоропреновый каучук.
Бутадиен получают по способу Лебедева из этилового спирта:
ZnO, Al2O3
 2 CH3−CH2−OH СН2=СН−СН=СН2 + 2 H2O + H2
2 CH3−CH2−OH СН2=СН−СН=СН2 + 2 H2O + H2
Изопрен получают дегидрированием 2-метилбутана:
 СН3−СН(CH3)−СН2 −СН3 СН2=С(CH3)−СН=СН2 + 2 H2
СН3−СН(CH3)−СН2 −СН3 СН2=С(CH3)−СН=СН2 + 2 H2

Хлоропреновый каучук используют для изготовления бензо- и маслостойкой резины, трубопроводов при перекачке нефтепродуктов.
АЛКИНЫ
Алкины – углеводороды, содержащие кроме σ-связей две π-связи (тройную связь) у одной пары углеродных атомов. Первый представитель этого класса веществ – ацетилен HC≡CH, в связи с чем алкины также называют ацетиленовыми углеводородами. Общая формула гомологического ряда алкинов Сn Н2n−2 (изомерны алкадиенам).
Номенклатура и изомерия алкинов
Названия ацетиленовых углеводородов образуются от названий соответствующих предельных углеводородов заменой окончания – ан на – ин.
Для алкинов характерны изомерия углеродного скелета и изомерия положения тройной связи
АЦЕТИЛЕН
1. Строение молекулы.
Молекула ацетилена содержит тройную связь и имеет линейное строение.

Гомологи ацетилена.
| CH º CH | CH º CH – СН3 | CH º C – СН2 – СН3 | СН3 – С º C – СН3 |
| этин | пропин | бутин-1 | бутин-2 |
2.Физические свойства ацетилена.
Ацетилен - газ без цвета, вкуса и запаха, легче воздуха, нерастворим в воде, растворим в ацетоне.
3. Химические свойства ацетилена.
Благодаря наличию тройной связи ацетилен вступает в реакции присоединения.
а) галогенирование
CH º CH + Br2 → CHBr = CHBr 1,2-дибромэтан
б)гидрирование
CH º CH + Н2 → CH2 = CH2
в) гидрогалогенирование
CH º CH + HCl → CH2r = CHCl винилхлорид
г) гидратация
CH º CH + Н2О  CH3 – СOH уксусный альдегид
CH3 – СOH уксусный альдегид
д) окисление раствором перманганата калия
CH º CH + 4[O] → H2C2O4 щавелевая кислота
е) димеризация
CH º CH + CH º CH → CH º CH – CH º CH2 винилацетилен
ж) тримеризация
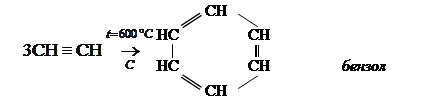
Горение
2C2H2 + 5O2 → 4CO2 + 2H2O
Получение ацетилена.
1. Карбидный способ.
CaC2 + 2H2O → C2H2 + Ca(OH)2
2. Пиролиз метана.