«Другого ничего в природе нет….
Ни здесь, ни там – в космических глубинах.
Все: от песчинок малых до планет
из элементов состоит единых»
Степан Щипачёв
Ранее изучалось строение атома. С помощью опытов Резерфорда, было установлено, что почти вся масса и весь положительный заряд атома сосредоточены в атомном ядре, вокруг которого вращаются отрицательно заряженные электроны. После этого открытия возникал резонный вопрос: а из чего состоит ядро? Ещё в 1913 году, Резерфорд предположил, что в состав любого атомного ядра входит ядро атома водорода. Это предположение было обусловлено тем, что масса ядра любого химического элемента была в целое число раз больше массы ядра атома водорода. Это дало основание рассматривать ядро атома водорода как элементарную частицу. Такая частица была названа протоном.

В 1919 году Резерфорд провел следующий опыт: он обстреливал ядро атома азота a-частицами. При попадании a-частицы в ядро азота, образовались два совершенно новых ядра: по предварительным оценкам, это были ядра атомов кислорода и водорода.
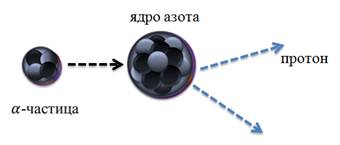
Однако полной уверенности в этом не было до тех пор, пока эксперимент не был повторен в камере Вильсона. На фотографии видны расходящиеся прямые линии – это следы a-частиц, которые не испытали соударений с ядрами атомов азота.

Тем не менее, на фотографии ясно видно, что след одной a-частицы раздваивается. Это говорит о том, что именно эта a-частица столкнулась с ядром атома азота. По характеру искривления треков было установлено (на этот раз точно), что образовавшиеся ядра действительно являются ядрами атомов кислорода и водорода. Таким образом, Резерфордом фактически была получена первая искусственная ядерная реакция.
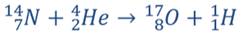
В уравнении, описывающем данную реакцию, символом 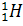 , обозначено ядро атома водорода, масса которого составляет приблизительно одну атомную единицу массы (1 а.е.м.), а заряд равен модулю элементарного заряда. Ядро атома водорода также обозначается символом
, обозначено ядро атома водорода, масса которого составляет приблизительно одну атомную единицу массы (1 а.е.м.), а заряд равен модулю элементарного заряда. Ядро атома водорода также обозначается символом 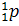 (то есть символом протона, поскольку это одно и то же). Впоследствии были проведены подобные эксперименты и с другими элементами, такими как натрий, алюминий, магний и многими другими. Из всех этих ядер a-частицы выбивали протоны, что подтверждало гипотезу Резерфорда.
(то есть символом протона, поскольку это одно и то же). Впоследствии были проведены подобные эксперименты и с другими элементами, такими как натрий, алюминий, магний и многими другими. Из всех этих ядер a-частицы выбивали протоны, что подтверждало гипотезу Резерфорда.
Тем не менее, очень скоро стало ясно, что ядра не состоят только из протонов. Дело в том, что это противоречило опытным данным. Для примера возьмем ядро бериллия, заряд которого равен четырем элементарным зарядам 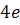 . Это говорит нам о том, что в ядре бериллия находится 4 протона. Если бы ядро состояло только из протонов, то масса ядра бериллия была бы равна 4 а.е.м. В действительности же, масса ядра бериллия составляет 9 а.е.м. Следовательно, в ядро входят еще какие-то частицы, причем не обладающие электрическим зарядом. Именно на основании этого, в 1929 году Резерфорд высказал предположение о существовании электрически нейтральной частицы, масса которой приблизительно равна массе протона.
. Это говорит нам о том, что в ядре бериллия находится 4 протона. Если бы ядро состояло только из протонов, то масса ядра бериллия была бы равна 4 а.е.м. В действительности же, масса ядра бериллия составляет 9 а.е.м. Следовательно, в ядро входят еще какие-то частицы, причем не обладающие электрическим зарядом. Именно на основании этого, в 1929 году Резерфорд высказал предположение о существовании электрически нейтральной частицы, масса которой приблизительно равна массе протона.
В 1930 году Вальтер Боте и его студент Герберт Беккер обнаружили следующее: при бомбардировке a-частицами ядра атома бериллия, из ядра исходит какое-то неизвестное излучение. Сначала было выдвинуто предположение о том, что это гамма-лучи, поскольку они имели высокую проникающую способность и никак не отклонялись в магнитном поле. Однако, от этой идеи пришлось отказаться, поскольку данное излучение обладало слишком большой энергией для гамма-лучей. В 1932 году изучением нового излучения занялся ученик Резерфорда - Джеймс Чедвик.

Он доказал, что неизвестное излучение – это на самом деле поток нейтральных частиц, масса которых приблизительно равна массе протона. Эту массу удалось определить по характеру взаимодействия с другими частицами. То, что частица электрически нейтральна, следовало из того, что она не отклонялась ни в электрическом, ни в магнитном поле. Такую частицу назвали нейтроном. Итак, нейтрон обозначается символом 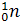 (поскольку не имеет заряда и обладает массой приблизительно равной 1 а.е.м.). Впоследствии точные измерения показали, что масса нейтрона чуть больше массы протона.
(поскольку не имеет заряда и обладает массой приблизительно равной 1 а.е.м.). Впоследствии точные измерения показали, что масса нейтрона чуть больше массы протона.
Практически сразу после открытия нейтрона физиками Дмитрием Иваненко и Вернером Гейзенбергом была предложена протонно-нейтронная модель строения ядра.
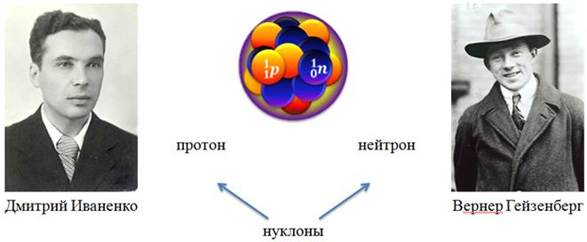
Работая независимо друг от друга, они пришли к выводу, что ядра атомов всех элементов состоят из двух видов частиц: протонов и нейтронов. Эти частицы стали называть нуклонами. Общее число нуклонов в ядре называется массовым числом (поскольку это число определяет массу ядра). Массовое число обозначается буквой А. Число протонов в ядре называется зарядовым числом (поскольку это число определяет заряд ядра). Зарядовое число обозначается буквой Z. Нетрудно догадаться, что число нейтронов в ядре равно разности общего числа нуклонов и числа протонов. То есть, чтобы найти число нейтронов, нужно из массового числа вычесть зарядовое число. Это число обозначается буквой N.
Итак, в общем случае, ядро любого химического элемента обозначается следующим образом:
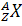
где Х – это символ элемента, Z – зарядовое число и А – массовое число. Еще раз уточним, что массовое число равно массе, выраженной в атомных единицах и округленной до целых. Зарядовое число равно заряду, выраженному в единицах элементарного электрического заряда. Для примера рассмотрим ядро натрия.

В таблице Менделеева, натрий имеет порядковый номер 11 – это и есть зарядовое число. Значит, в ядре натрия содержится 11 протонов. Поскольку атом в целом электрически нейтрален, можно заключить, что в атоме содержится 11 электронов. В таблице Менделеева также указана масса натрия – 23. Значит, в ядре натрия содержится 12 нейтронов. Итак, чтобы определить количество протонов, нейтронов и электронов в атоме, нужно сделать следующее:
– Посмотреть в таблице Менделеева порядковый номер интересующего вас элемента. Таким образом, определяетс зарядовое число – то есть число протонов и число электронов.
– Посмотреть массу этого элемента в таблице Менделеева и округлить её до целых (она почти всегда очень близка к целому числу). Таким образом, определяется массовое число, то есть общее число нуклонов. Для нахождения числа нейтронов, нужно из массового числа вычесть зарядовое число.
Необходимо отметить, что существуют атомы, которые ничем не отличаются друг от друга по своим химическим свойствам, но обладают различным массовым числом. Впервые, на существование таких атомов обратил внимание Фредерик Содди, который работал вместе с Резерфордом. Содди предложил называть такие атомы изотопами. С помощью опытов было установлено, что изотопы одинаково вступают в химические реакции и образуют одинаковые соединения. Это говорило о том, что число электронов в электронных оболочках (а, значит, и заряд ядра) у изотопов одинаковы. Стало быть, в ядрах изотопов содержалось различное число нейтронов.
На сегодняшний день найдены изотопы всех химических элементов. Например, водород имеет три изотопа: протий, дейтерий и тритий.
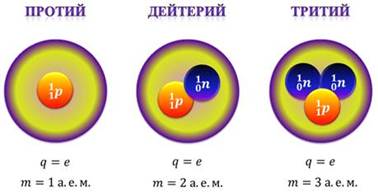
Ядро протия состоит только из одного протона (это самый распространенный изотоп водорода). То есть, заряд ядра протия равен элементарному заряду, а масса равна одной атомной единице. Ядро дейтерия включает в себя один протон и один нейтрон. Таким образом, заряд ядра дейтерия тоже равен элементарному, но масса уже равна двум атомным единицам. Наконец, ядро трития содержит один протон и два нейтрона. Заряд ядра трития опять-таки равен элементарному заряду, а вот масса равна трем массовым единицам.
Другие химические элементы могут иметь значительно больше изотопов: например у урана их насчитывается 26. Наиболее распространенные изотопы урана – это уран 235 и уран 238 (поскольку зарядовое число изотопов одинаковое, имеет смысл упоминать только массовое число, чтобы понять, о каком изотопе идет речь).

Надо сказать, что некоторые изотопы могут являться радиоактивными. В связи с этим, изотопы делятся на стабильные и нестабильные. Стабильные изотопы сохраняются неизменными сколь угодно долго, а нестабильные изотопы со временем превращаются в другие химические элементы в результате радиоактивного распада.
Именно из-за существования изотопов, для большинства элементов в таблице Менделеева указана дробная масса. Дело в том, что эта масса вычисляется как средняя масса всех изотопов с учетом степени распространения каждого изотопа. Например, как мы уже убедились, водород имеет три изотопа с массовыми числами один, два и три. Но протий распространен гораздо больше: его содержание в природе составляет почти 99,99%. Поэтому в таблице Менделеева масса водорода практически равна единице.
Возникает важнейший вопрос: как же ядра многих изотопов остаются стабильными? Что удерживает нуклоны в ядре? Ведь между положительно заряженными протонами должны возникать силы электростатического отталкивания. Силы, удерживающие протоны и нейтроны в ядре называются ядерными силами. Нетрудно догадаться, что раз протоны не разлетаются в разные стороны, значит, ядерные силы значительно мощнее, чем электростатические силы. Но ядерные силы действуют на очень малом расстоянии, то есть в пределах атомного ядра. Эти силы фундаментально отличаются от гравитационного или электромагнитного взаимодействия и относятся к сильному взаимодействию, о котором упоминалось в девятом и десятом классах. Также к свойствам ядерных сил можно отнести то, что они не являются центральными (то есть не действуют вдоль прямой, соединяющей частицы). Кроме того, ядерные силы не зависят от величины заряда частиц (поскольку они действуют и на незаряженные частицы – нейтроны).
Основные выводы:
– После открытия протона и нейтрона была предложена протонно-нейтронная модель ядра.
– Согласно этой модели все ядра атомов состоят из протонов и нейтронов. Частицы, входящие в состав ядра назвали нуклонами.
– Общее число нуклонов в ядре называется массовым числом, а число протонов в ядре называется зарядовым числом.
– Массовое число А численно равно массе ядра данного химического элемента, выраженной в атомных единицах массы и округленной до целого.
– Зарядовое число Z численно равно заряду ядра, выраженному в единицах элементарного электрического заряда.
– Число нейтронов в ядре определяется как разность массового и зарядового чисел.
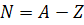
– В результате исследований было открыто существование разновидностей каких-либо химических элементов, которые обладали одинаковыми химическими свойствами, но имели различную массу. Такие разновидности назвали изотопами.
– Ядерные силы – это силы, удерживающие нуклоны в ядре в течение длительного времени. Тем не менее, ядерные силы не распространяются за пределы атомных ядер.
Еще в 1913 году Эрнест Резерфорд сделал предположение, что в ядра атомов всех химических элементов входит ядро атома водорода, которое впоследствии стало называться протоном. Только в 1919 году Резерфорду удалось доказать, что его гипотеза верна. При бомбардировке ядер атомов азота a-частицами, образовывались ядра атомов совсем других химических элементов: кислорода и водорода. Однако очень скоро стало ясно, что в состав атомного ядра входят еще какие-то частицы. В 1932 году Джеймсу Чедвику и его группе удалось зарегистрировать частицу, которая выбивалась из ядра атома бериллия при бомбардировке a-частицами. Выяснилось, что эта частица электрически нейтральна и обладает массой, приблизительно равной массе протона. Такую частицу называли нейтроном. После открытия протона и нейтрона была предложена протонно-нейтронная модель атома, согласно которой, ядра атомов всех химических элементов состоят из протонов и нейтронов. Тогда возник вопрос: каким образом, нуклоны удерживаются в ядре, несмотря на электростатическое отталкивание между протонами? Силы, действующие в пределах атомных ядер, называются ядерными силами. Эти силы являются самыми мощными силами в природе. Ну а раз в ядре действуют такие мощные силы, значит, там сосредоточена значительная энергия. Эту энергию стали называть энергией связи. То есть, энергия связи – это энергия, которая потребовалась бы, чтобы разделить ядро на отдельные нуклоны. Известно, что в результате экспериментов были определены массы протона и нейтрона. Но когда начали определять массу атомных ядер, выяснилась очень интересная особенность: масса ядра атома всегда оказывалась меньше, чем сумма масс, входящих в него частиц.
Для примера рассмотрим ядро атома кислорода.
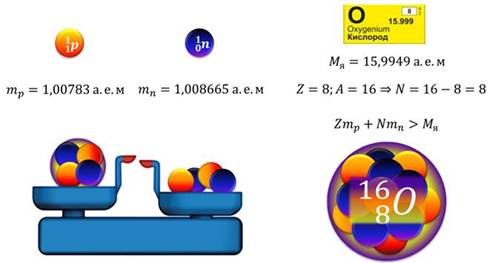
Порядковый номер кислорода в таблице Менделеева – это 8, а массовое число – 16. Значит, в ядре атома кислорода содержится 8 протонов и 8 нейтронов. Ядро атома данного изотопа кислорода имеет массу, равную 15,9949. Поскольку масса протона, как и масса нейтрона, чуть больше одной атомной единицы массы, ясно, что их суммарная масса будет больше массы ядра атома кислорода. Такую разницу назвали дефектом масс. То есть, дефект масс – это разность между суммарной массой нуклонов, входящих в состав атомного ядра и массой самого ядра.
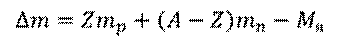
Но куда же пропадает эта масса? Дело в том, что при образовании ядра была затрачена некоторая энергия. В соответствии с известным уравнением Эйнштейна, масса может превращаться в энергию, и, наоборот – энергия – в массу.
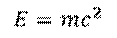
Именно таким образом можно определить энергию связи ядер. Для этого нужно дефект масс умножить на скорость света в квадрате, и мы получим энергию в джоулях.
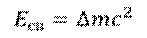
Но, обратите внимание, что в данной формуле масса должна измеряться в килограммах, а не в атомных единицах. Для удобства в атомной физике используют другую формулу: дефект масс в атомных единицах умножают на 931,5, и получают энергию в мегаэлектрон-вольтах.
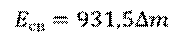
Дело в том, что
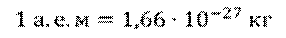
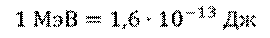
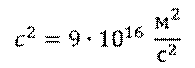
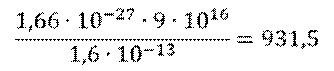
На сегодняшний день известно, что дефект масс присутствует во всех ядрах, кроме ядра протия, поскольку ядро протия состоит из одного протона.
Возьмем произвольный элемент и обозначим его 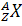 . Число протонов в ядре атома данного элемента равно зарядовому числу (то есть, Z). Число нейтронов в этом ядре равно разности между числом нуклонов и числом протонов (т.е.,
. Число протонов в ядре атома данного элемента равно зарядовому числу (то есть, Z). Число нейтронов в этом ядре равно разности между числом нуклонов и числом протонов (т.е., 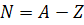 ). Тогда, дефект масс
). Тогда, дефект масс
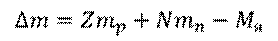
Энергия связи равна

Ещё раз обратите внимание, что в данной формуле дефект масс должен быть выражен в атомных единицах массы, а энергия получится в мегаэлектрон-вольтах (МэВ).
Ещё одной очень важной величиной в атомной физике является удельная энергия связи. Удельная энергия связи – это энергия связи, приходящаяся на один нуклон ядра. Эта величина характеризует, насколько стабильны те или иные ядра атомов.
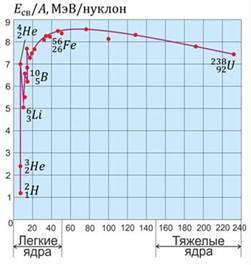
На рисунке представлен график зависимости удельной энергии связи от массового числа. Как видно из графика, легкие ядра обладают довольно малой энергией связи (за исключением гелия два четыре 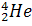 ). К середине таблицы Менделеева энергия связи достигает максимального значения, а к концу – снова начинает убывать. То есть, для получения ядерной энергии разумно либо синтезировать легкие ядра, либо делить тяжелые ядра. Известно, что на данный момент человечество использует деление тяжелых ядер. Во многих ядерных реакторах происходит деление ядер урана. Синтез легких ядер происходит на Солнце, в результате чего освобождается колоссальное количество энергии, которое в частности передается Земле в виде света и тепла.
). К середине таблицы Менделеева энергия связи достигает максимального значения, а к концу – снова начинает убывать. То есть, для получения ядерной энергии разумно либо синтезировать легкие ядра, либо делить тяжелые ядра. Известно, что на данный момент человечество использует деление тяжелых ядер. Во многих ядерных реакторах происходит деление ядер урана. Синтез легких ядер происходит на Солнце, в результате чего освобождается колоссальное количество энергии, которое в частности передается Земле в виде света и тепла.
Разумеется, физики стремятся найти способ контролировать такие процессы, то есть, получить управляемую термоядерную реакцию. На сегодняшний день, эта цель ещё не достигнута. Термоядерная реакция на данный момент, неуправляема и реализована только при создании водородной бомбы (разумеется, если цель – это создать взрыв, то управляемая реакция не нужна).
Тем не менее, уже сегодня существуют установки, которые называются «Токамак» - тороидальная камера с магнитными катушками.
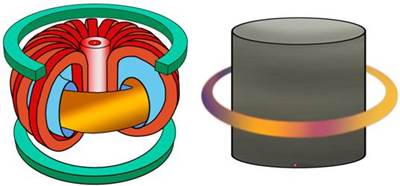
В этих установках с помощью магнитных полей удерживается плазма, с помощью которой планируют осуществить управляемый термоядерный синтез. Поскольку плазма – это ионизированный газ, она подвержена влиянию магнитных полей. Таким образом, плазма скручивается в шнур и не касается стенок камеры, не принося ей никакого вреда. Поэтому, есть основания полагать, что в скором времени люди всё-таки научатся управлять термоядерными реакциями.
Упражнения.
Задача 1. Определите энергию связи ядра Fe-56 в МэВ и найдите удельную энергию связи.

Задача 2. Найдите массу урана 238, расходуемую АЭС для выделения того же количества энергии, которое расходует ТЭС при сжигании 100 т нефти?

Основные выводы:
– Дефект масс – это разность между суммарной массой нуклонов, входящих в состав ядра и массой самого ядра.
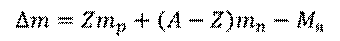
– Дефект масс возникает из-за того, что на образование атомных ядер затрачивается энергия – энергия связи. Эту энергию можно вычислить в соответствии с формулой Эйнштейна, которая описывает взаимосвязь между энергией и массой.
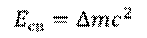
– Для вычисления энергии связи в мегаэлектрон-вольтах можно воспользоваться более простой формулой, с которой мы также познакомились на сегодняшнем уроке.
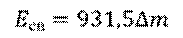
– Удельная энергия связи – то есть энергия связи, приходящаяся на один нуклон.
– Основной задачей ядерной физики является получение управляемой термоядерной реакции.