Школьный этап Всероссийской олимпиады по химии
Учебный год
Задания для 11 класса (максимальный балл-53)
Задача 1
Х - металл серо-белого цвета, 14-ый по распространённости элемент на Земле. На данный момент известны 5 аллотропных модификаций этого металла. Часто сопутствует своему соседу по периоду в таблице Менделеева в его рудах, наиболее распространенных в земной коре, при этом имеет и самостоятельные месторождения. Соединение С хорошо известно и применяется для осветления стекла.
| HNO3(р) |
| PbO2, |
| Cl2 |
| K2O2 |
| t° |
| H2SO4(к) |
 B
B  C
C  D
D  E
E
| O2 |
| HCl |
| KCN |
| KCN |
C  F
F  G
G  H
H
Известно, что:
1. Все соединения А – Н содержат элемент Х.
2. В сильно щелочной среде соединение Е самопроизвольно переходит в D, E и D имеют одинаковый элементный состав.
3. H – комплексное соединение, образующее кристаллогидрат синего цвета
Задания:
1. Определите элемент X и соединения A – H. Приведите уравнения указанных на схеме реакций.
2. Известно, что соль A образует несколько кристаллогидратов – J1, J2, J3. Приведите формулы этих соединений, если массовая доля X в них равна 24,66%, 22,82%, 19,85% соответственно (молярные массы для удобства округлите до целых).
3. Предложите ещё один способ превращения А в В.
Решение задачи 1:
Наиболее распространены железные руды =˃ X – кобальт или марганец. Соединение С – очевидно, оксид, который применяется для осветления стекла. Определённо не кобальт. Можно сделать вывод, что Х – марганец. (1 балл)
Реакции:
1) Mn + 2H2SO4 = MnSO4 + SO2↑+ 2H2O
2) 2MnSO4 + 5PbO2 + 6HNO3(разб.) = 2HMnO4 + 2PbSO4 + 3Pb(NO3)2 + 2H2O
3) 4HMnO4 = 4MnO2 + 3O2↑ + 2H2O
4) MnO2 + K2O2 = K2MnO4
5) 2K2MnO4 + Cl2 = 2KMnO4 +2KCl
6) Mn + O2 = MnO2
7) MnO2 + 4HCl = MnCl2 + Cl2 ↑+ 2H2O
8) MnCl2 + 2KCN = Mn(CN)2 + 2KCl
9) Mn(CN)2 + 4KCN = K4[Mn(CN)6] по 1 баллу за каждое уравнение) - 9 баллов
1. X – Mn
A – MnSO4 B – HMnO4 C – MnO2 D – K2MnO4 E – KMnO4 F – MnCl2 G – Mn(CN)2
H – K4[Mn(CN)6] по 0,5 баллов за вещество - 4 балла
2. Кристаллогидраты будут иметь вид MnSO4∙nH2O.
W(Mn) = 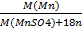 , тогда
, тогда
n = 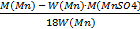
J1:n=(55 г/моль – 0,2466∙151 г/моль)/(18 г/моль∙0,2466) 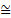 4
4
J1 – MnSO4∙4H2O 1 балл
Аналогично с J2 и J3:
J2 – MnSO4∙5H2O 1 балл
J3 -MnSO4∙7H2O 1балл
3. 2MnSO4 + 5NaBiO3 + 16HNO3 = 2HMnO4 + 5Bi(NO3)3 + NaNO3 + 2Na2SO4 + 7H2O 2 балла
ИТОГО 19 баллов
Задача 2
Предлагаем вам список препаратов, которые позиционируются в качестве лекарства от Covid-2019 в интернете:
| Фармацевтическое название | Молекулярная формула и масса | Структурная формула | Информация из интернета |
| Хлорохин | ……… | 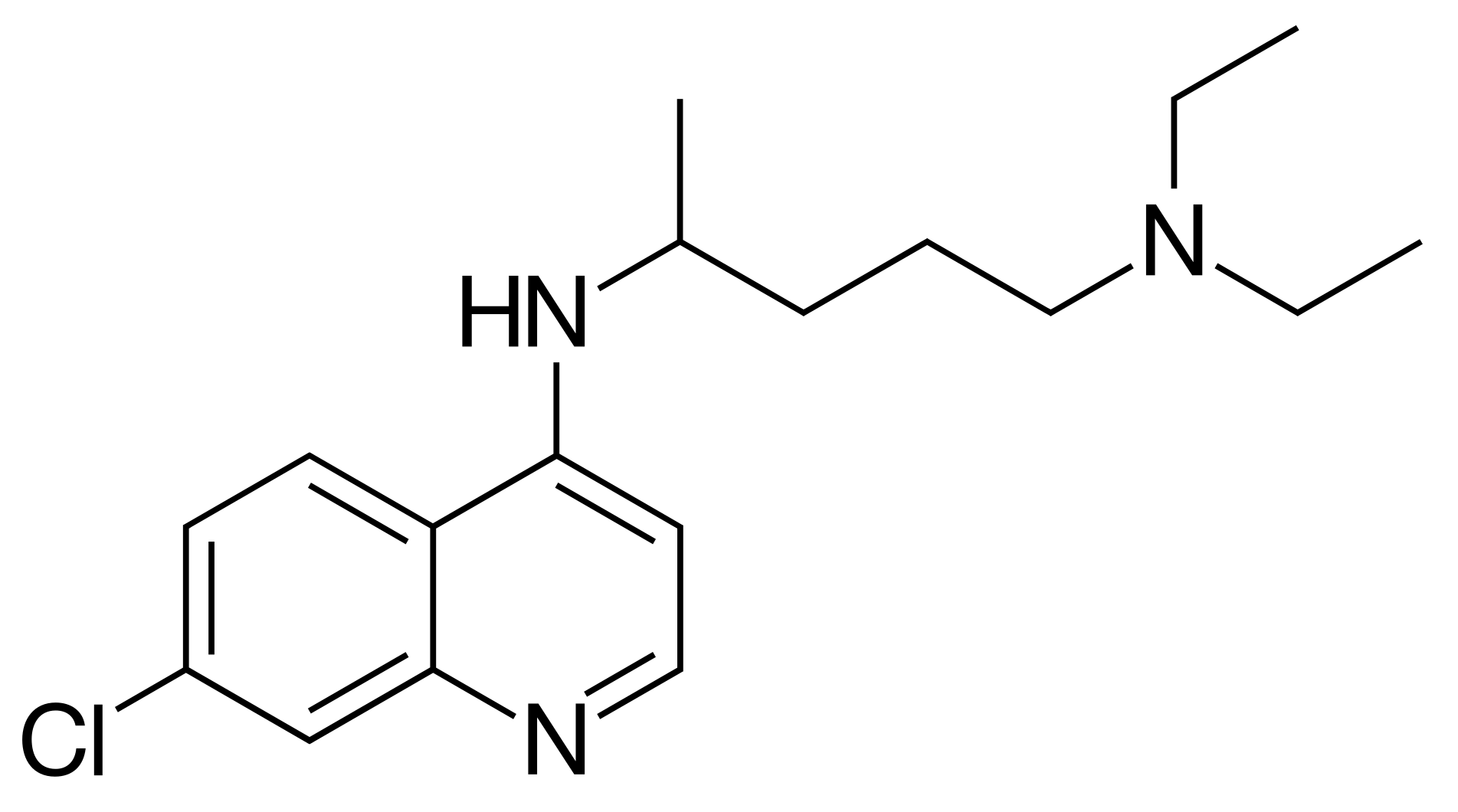
| Это широкодоступное лекарственное средство, которое регулярно используется с 1945 года против малярии, внекишечного амебиаза и ряда других заболеваний. Лабораторные исследования обнаружили, что данный антивирусный препарат был эффективен против коронавируса, по крайней мере, в чашке Петри. А результаты небольшого французского исследования с участием 24 пациентов, позволяют предположить, что прием «Хлорохина» может ускорить выздоровление. |
| Парацетамол | ………. | 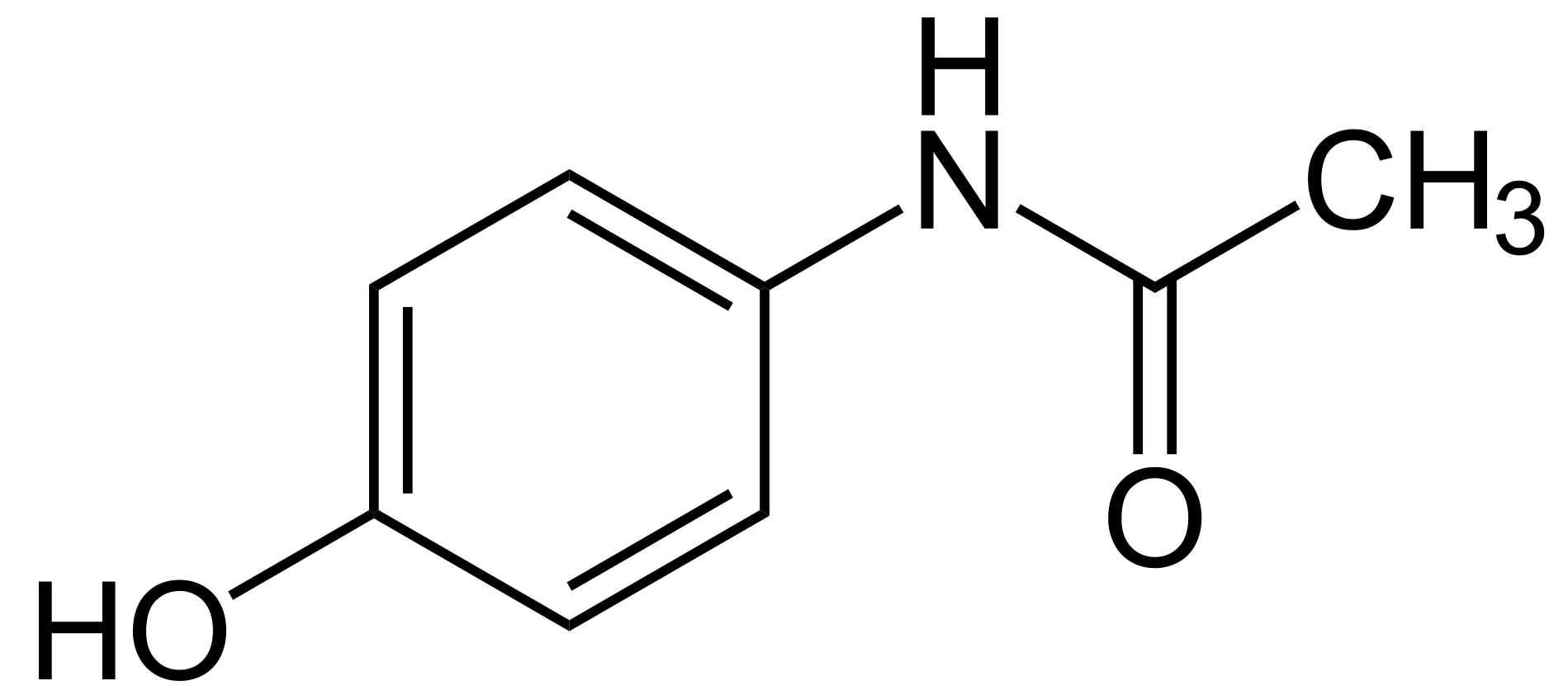
| Является широко распространённым центральным ненаркотическим анальгетиком, обладает довольно слабыми противовоспалительными свойствами. Вместе с тем при приёме больших доз может вызывать нарушения работы печени, кровеносной системы и почек[3]. Риск нарушений работы данных органов и систем увеличивается при одновременном принятии спиртного, поэтому лицам, употребляющим алкоголь, рекомендуют употреблять пониженную дозу парацетамола. |
| Ремдесивир | ………. | 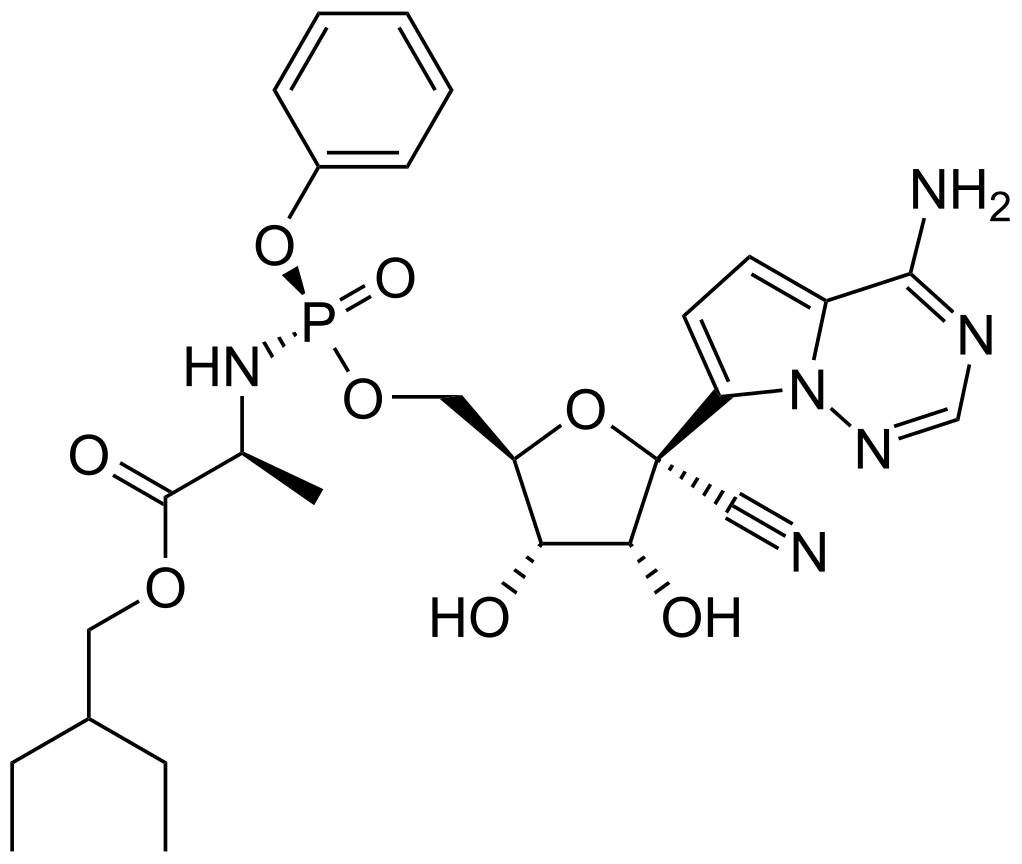
| Ремдесивир относится к классу противовирусных препаратов, которые ингибируют РНК-зависимую РНК-полимеразу |
| Авиган (Фавипиравир) | ……. | 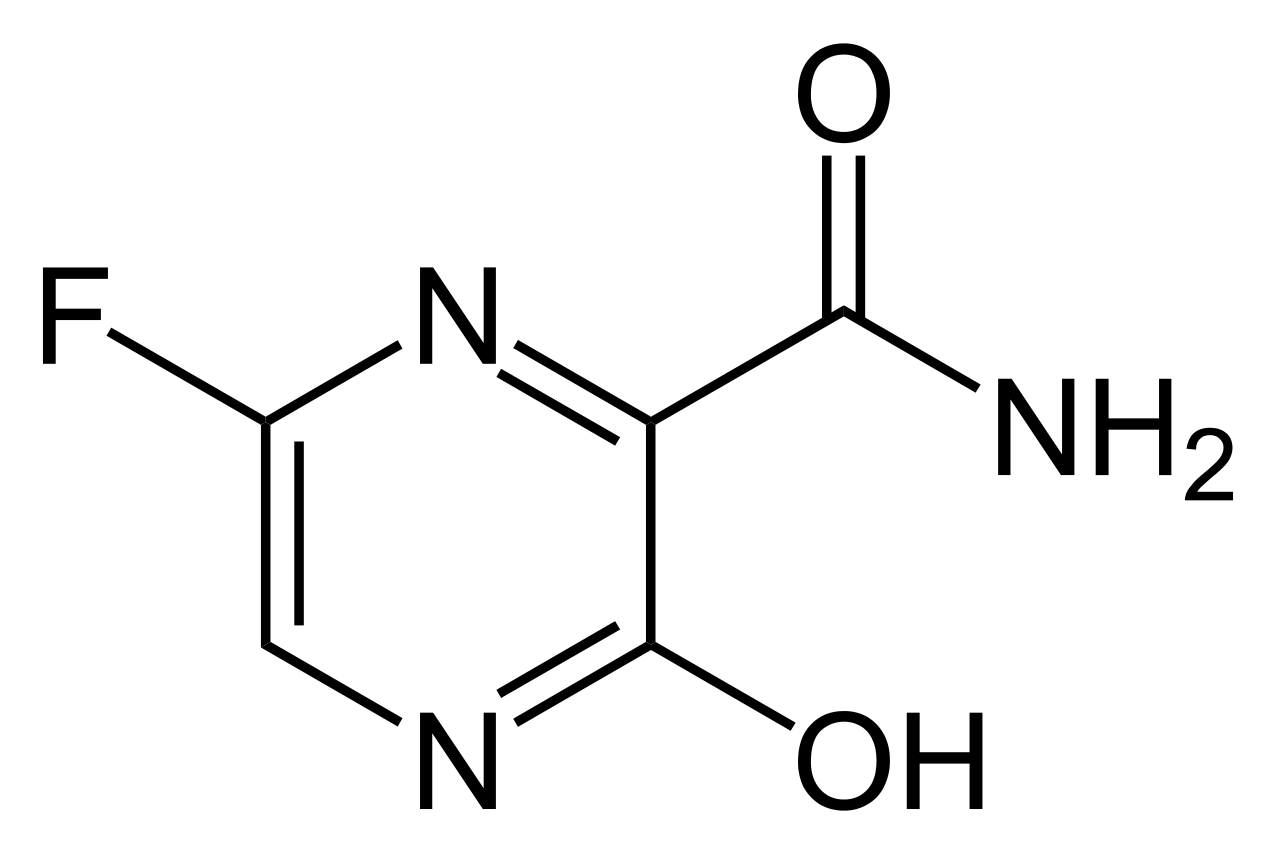
| противовирусный препарат, разработанный в Японии для лечения гриппа[1]. Обладает широким спектром активности против РНК-содержащих вирусов, включая вирусы гриппа, риновирус, респираторно-синцитиальный вирус, а также опасные для жизни вирусы. |
| Ингаверин | …………. | 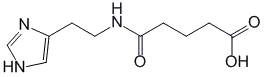
| Механизм противовирусного действия витаглутама неясен, у него отсутствует прямое вирусспецифическое действие. Интерфероногенными свойствами он также не обладает. Эффективность препарата не доказана, лекарство на его основе распространено только в России. |
1. Для каждой из приведенных структур приведите молекулярную формулу и молярную массу.
2. В каждой структуре выделите по две функциональные группы и дайте им название
3. Для ингаверина напишите уравнение реакции а)с соляной кислотой б) со щелочью
Решение задачи 2
| Фармацевтическое название | Молекулярная формула и масса |
| Хлорохин | C18H26ClN3 М=319,5 г/моль 1 балл |
| Парацетамол | C8H9NO2 М=151 г/моль 1 балл |
| Ремдесивир | C27H35N6O8P М=602г/моль 1 балл |
| Авиган (Фавипиравир) | C5H4FN3O2 М= 157 г/моль 1 балл |
| Ингаверин | C10H15N3O3 М=225г/моль 1 балл |
Хлорохин
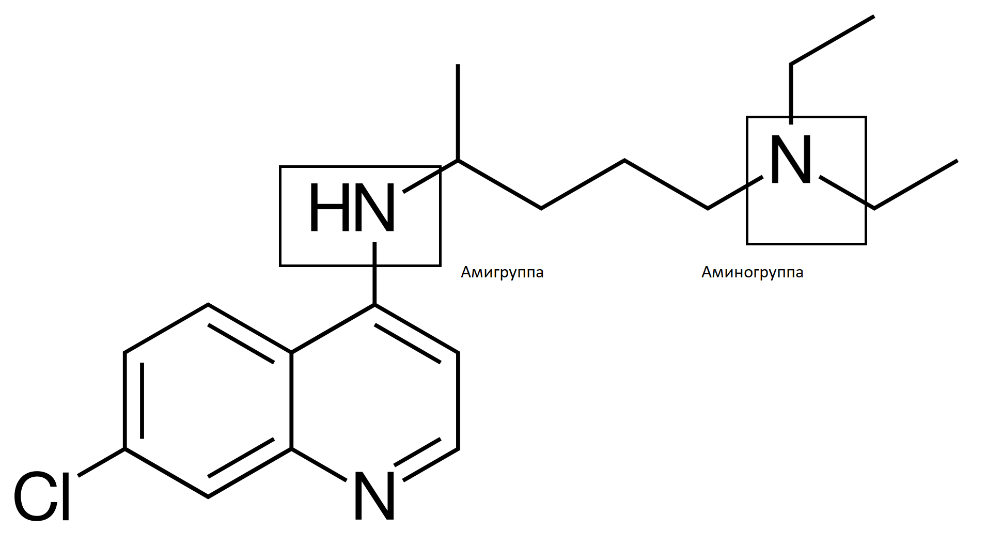 1 балл
1 балл
Парацетомол
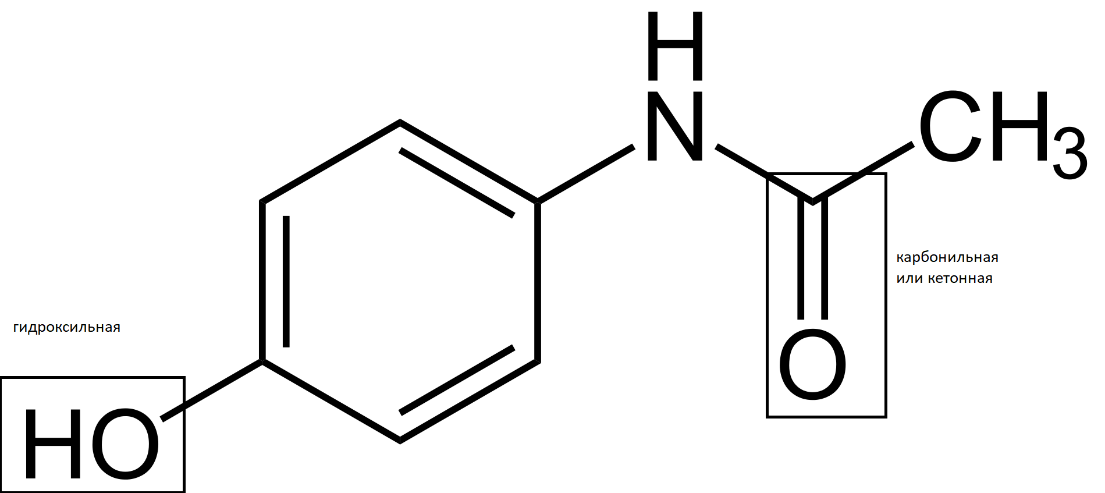 1 балл
1 балл
Ремдесивир
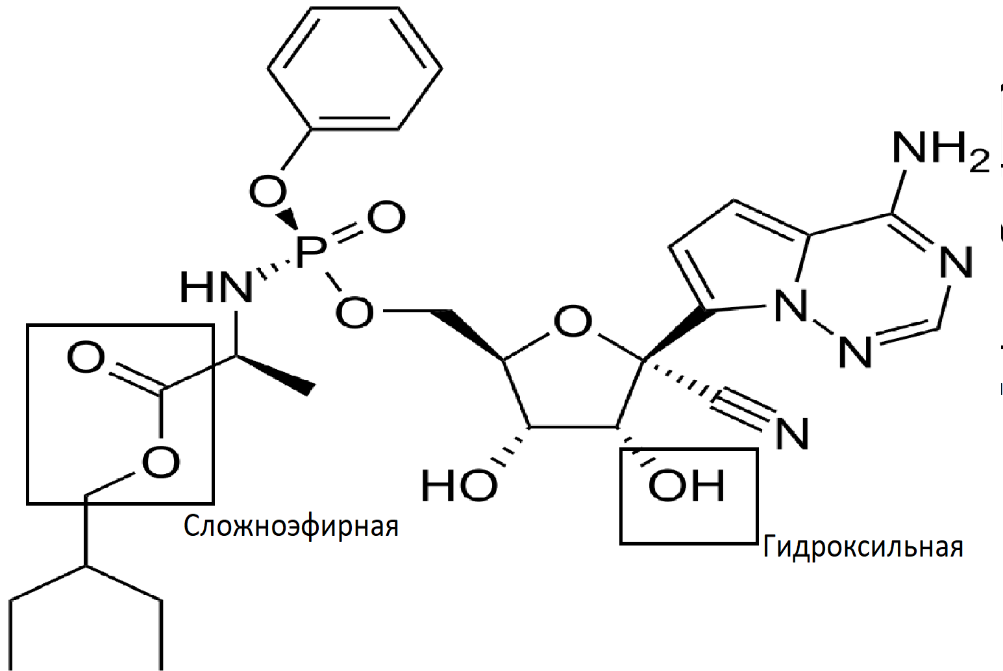 1 балл
1 балл
Авиган
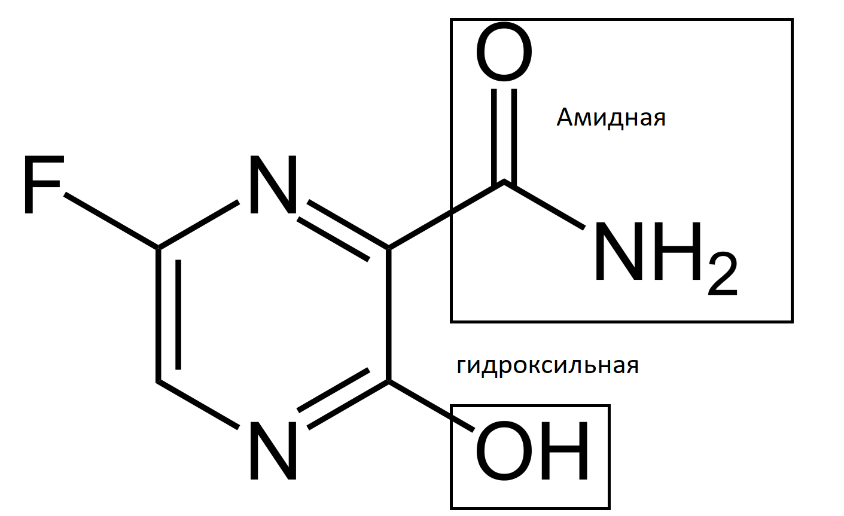 1 балл
1 балл
Ингаверин
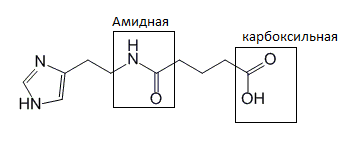 1 балл
1 балл

По 1 баллу за каждое уравнение
ИТОГО 12 баллов
Задача 3
X -простое вещество, название которого с древнегреческого переводится как «запах». Вещество X имеет наибольшую известную плотность. 19 грамм вещества X, реагируя с кислородом, образует вещество А (реакция 1). Вещество А - крайне токсичное соединение, летучее вещество с запахом гнилой редьки. Если же ко всему образовавшемуся А добавить избыток Х, образуется вещество В массой 44,4 грамма (реакция 2). Другим способом получения В является реакция А с монооксидом азота с выделением бурого газа (реакция 3). А, реагируя с нитритом калия в щелочном растворе, образует вещество С (реакция 4). Процентное содержание Х в С составляет 51.63%. При 200°С С разлагается, превращаясь в D (реакция 5). D, реагируя с серной кислотой, образует А и В (реакция 6).
1.Определите вещества Х, А-D.
2.Напишите реакции 1-6.
Решение задачи 3:
1. Х - Os; A - OsO4; B - OsO2; C - K2OsO4*2H2O; D - K2OsO4.
2. (1) Os+2O2=OsO4
(2) OsO4+Os=2OsO2
(3) OsO4+2NO=OsO2+2NO2
(4) OsO4+KNO2+2KOH+H2O=K2OsO4*2H2O+KNO3
(5) K2OsO4*2H2O=K2OsO4+2H2O при 200°С
(6) 2K2OsO4+2H2SO4=OsO4+OsO2+2K2SO4+2H2O
1.За каждое правильно написанное вещество-1 балл. Итого: 5 баллов.
2.За каждое правильное уравнение (с коэффициентами)- 1 балл. За каждое полуправильное уравнение (без или с неправильными коэффициентами)- 0.5 балла.
Итого: 6 баллов.
3.3а подтверждение состава веществ с помощью расчёта-2 балла.
Итого:2 балла.
Общее количество баллов-13.
Задача 4
Нередко медь образует соединения со степенью окисления +3. К таким соединениям относят купраты. Прокаливая гидроксид меди (II) с пероксодисульфатом калия (W(K)=28,89%) (реакция 1), получили гранатово-красный кристаллический порошок А (W(O)= 27,12%), который под действием щелочи превращается в купрат металла Х (W(O)=37,54%, содержит 4 атома кислорода). (реакция 2)
1. Вычислите формулу купрата металла Х
2. Напишите уравнения реакций 1 и 2
3. Напишите уравнение реакции металла Х с его гидрооксидом
Решение задачи 4
1. 4 атома кислорода имеют массу 64. Значит молярная масса купрата 64/0,3754=170,5 г/моль. 170,5-64-63,5= 43. Учитывая, что 4 атома кислорода несут заряд 8- медь 3+, металл щелочной 1+. Еще 4+ скорее всего приходятся на 4 атома водорода. Значит формула купрата K[Cu(OH)4]. 3 балла
2. Реакция 1 2 Cu(OH)2 + K2S2O8 à Cu2O3 + K2S2O7 +2H2O 2 балла
Реакция 2 Cu2O3 + 2 КОН + 3 H2O à 2 K[Cu(OH)4] 2 балла
4. KOH + K = K2O + H2 2 балла
ИТОГО 9 баллов