27.03.2020
ЛЕКЦИЯ 5.
ПОЛУЧЕНИЕ АМИНОКИСЛОТ, ВИТАМИНОВ И КОФЕРМЕНТОВ
Витамины представляют низкомолекулярные органические соединения, необходимые для жизнедеятельности организма, синтез которых в организме либо ограничен, либо отсутствует. Не подлежит сомнению исключительно высокая биологическая активность витаминов. Потребность в них для организма человека вполне достаточна в очень небольших количествах (от нескольких микрограммов до нескольких десятков миллиграммов в день).
Витамины, не являясь пластическим материалом или источником энергии, служат активными биокатализаторами разных метаболических процессов в организме. Почти все водорастворимые
витамины, а также жирорастворимый витамин К являются ко-ферментами или кофакторами биохимических реакций. Витамины A, D, Е регулируют генетический аппарат клетки. Помимо этого абсолютно каждому витамину свойственна своя, специфическая функция в организме. Все это указывает на незаменимость витаминов для жизнедеятельности организма.
В современных социально-экономических условиях вследствие индустриализации и достижений цивилизации человек изменил характер питания и стал употреблять много рафинированных и консервированных продуктов, обладающих меньшей витаминной ценностью. В качестве примера можно привести муку высших сортов, при производстве которой теряется до 80—90 % всех витаминов. Другой пример, при операции экстрагирования, дезодорирования и осветления растительных масел разрушаются жирорастворимые витамины. Витамины А, Е, К и каротин достаточно устойчивы к термообработке, но весьма чувствительны к свету и кислороду воздуха. Для стран со слабо развитой экономикой дефицит витаминов приобретает массовое явление вследствие достаточно низкого прожиточного минимума для большинства населения этих стран, одновременно с этим снижается качество питания из-за отсутствия в нем свежих овощей, фруктов, мяса, рыбы.
Широкое распространение полигиповитаминозов, снижение резистентности организма к болезнетворным микроорганизмам, сопровождающееся вредными экологическими факторами (радиацией, канцерогенами, промышленными токсинами) — все это повышает роль витаминов в профилактической и лечебной работе врачей, поэтому в экономически развитых странах стали реализо-вываться государственные программы искусственной витаминизации пищевых продуктов (муки, хлеба, молока, соков и др.).
В основе классификации витаминов (табл. 1) находятся их физико-химические свойства, в соответствии с которыми все витамины делят на водо- и жирорастворимые.
Известно, что водорастворимые витамины в тканях не накапливаются (за исключением витамина В|2), из чего следует необходимость их ежедневного поступления в организм. Жирорастворимые витамины способны накапливаться в тканях, поэтому их недостаточность или дефицит встречаются реже. Для них не свойственна и коферментная функция (кроме витамина К). Интересно, что, выполняя функцию индукторов синтеза белков, представители жирорастворимых витаминов проявляют сходство со стероидными гормонами, особенно это имеет отношение к витамину D. И, наконец, все жирорастворимые витамины являются структурными компонентами клеточных мембран, проявляя антиоксидантное действие.
Обращаясь к источникам витаминов, можно сказать, что приоритет в этом случае остается за растениями. Не секрет, что на содержание витаминов в пищевых продуктах существенно влияет
Классификация витаминов
Таблица 1
| Буквенное обозначение | Химическое название | Активная форма витамина | Лечебный эффект |
| Водорастворимые витамины | |||
| в, | Тиамин | Тиаминпирофосфат (ТПФ), кокарбокси-лаза, тиаминтри-фосфат (ТТФ) | Антиневритный |
| в2 | Рибофлавин | ФМН,ФАД | Витамин роста |
| Вз | Пантотеновая кислота | KoA-SH, дефосфоКоА, 4-фосфопантетеин | Антидерматитный |
| В5(РР) | Ниацин | НАД+ и НАДФ+ | Антипеллагри-ческий |
| в6 | Пиридоксин | Пиридоксальфосфат, пиридоксамино- фосфат | Антидерматитный |
| В,2 | Кобаламин | Метилкобаламин, дезоксиаденозинко- баламин | Антианемический |
| с | Аскорбиновая кислота | Аскорбиновая и де- гидроаскорбиновая кислоты | Регулятор метаболических процессов, иммуностимулятор |
| Жирорастворимые витамины | |||
| А | Ретинол | Ретинол/ретиналь | Антиксеро-фтальмический |
| D | Кальциферол | Эргокальциферол | Антирахитический |
| Е | Токоферол | а-, (3-, у-, 5-токофе-ролы, токотриенолы | Антиоксидантный |
| К | Филлохинон | Дифарнезилнафто-хинон | Антигеморрагический |
тот или иной сезон календарного года и кулинарная обработка, что опять нас возвращает к вопросу организации рационального и сбалансированного питания.
Научные исследования последних лет показали не только высокую биологическую активность витаминов, но и то, что, как правило, этой активностью обладают не сами витамины, а их производные — коферменты, которые нашли широкое применение в медицинской практике.
Если говорить о производстве основной части витаминной продукции, то ведущее положение здесь занимают химические методы, но в ряде производств в качестве их полноправного конкурента как в нашей стране, так и за рубежом, выступают биотехнологические методы, использование которых более предпочтительно в связи с ужесточением экологических требований к фармацевтическому производству. Кроме того, при применении биотехнологических методов появляются возможности сокращения части стадий химического синтеза за счет использования высокоактивных штаммов микроорганизмов-продуцентов. Например, производство витаминов В12, В2, В3 и D (эргостерина) осуществляется в одну стадию. Также микроорганизмы нашли свое применение и в синтезе витамина С, убихинонов, каротиноидов.
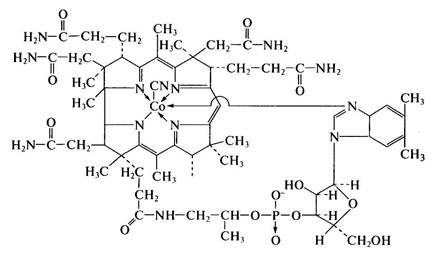
Витамин В12 (кобаламин)
В настоящее время витамин В,2 получают чисто биотехнологическими методами. Витамин В12 является производным внутреннего кобальтового комплекса нуклеотида бензимидазола и макро-циклической корриновой системы. Способность синтезировать соединения корриноидной природы широко распространена среди прокариотических микроорганизмов. Так, некоторые мутант-ные штаммы пропионовых бактерий из рода Propionibacterium
способны продуцировать свыше 50 мг витамина Вп на 1 л среды, а в присутствии его предшественника 5,6-диметилбензимидазола (5,6-ДМБ) накапливать до 200 мг на 1 л культуральной жидкости. Культивируют продуценты витамина В|2 на средах, приготовленных из пищевого сырья (кукурузный и мясной экстракты, соевая и рыбная мука). В настоящее время успешно ведется поиск активных продуцентов, образующих достаточное количество витамина на средах, из непищевого сырья, когда в качестве источника углерода и энергии используются изопропиловыи спирт, метанол и др. Пропионовые бактерии выращивают периодическим методом в анаэробных условиях на среде, содержащей кроме пищевого сырья глюкозу, соли кобальта и сульфат аммония.
В процессе ферментации образуются кислоты, которые затем нейтрализуют, непрерывно подавая в ферментер раствор щелочи. Через 72 ч после начала ферментации в питательную среду вносят предшественник (5,6-ДМБ), так как без добавления последнего вместо витамина В,2 синтезируются фактор В (кобинамид) и не обладающий терапевтическим эффектом псевдовитамин В)2, у которого азотистым основанием служит аденин. Общее время ферментации — 6 сут. По ее окончании витамин В12 остается в клетках бактерий, т.е. в биомассе, которую далее сепарируют, а целевой продукт экстрагируют подкисленной водой.
Необходимо отметить, что в качестве новых перспективных разработок создан высокопродуктивный штамм Propionibacterium ari, способный в отличие от ранее известных продуцентов вьщелять витамин В|2 в культуральную среду. Для предотвращения образования коферментной формы витамина В,2 в качестве стабилизатора добавляют нитрит натрия. Далее следуют стандартные стадии выделения и очистки, поэтому подробно на них останавливаться не будем. Полученный продукт используется для изготовления разных лекарственных форм препарата и в производстве поливитаминных препаратов.
Витамин В2 (рибофлавин)
ОН ОН ОН
I I I сн2-сн—сн—сн-сн2он
Биосинтез флавинов осуществляется как растительными, так и многими бактериальными клетками, а также плесневыми гри-

бами и дрожжами. Благодаря именно микробному биосинтезу рибофлавина в желудочно-кишечном тракте жвачные животные не нуждаются в этом витамине. У человека синтезирующихся флави-нов недостаточно для предупреждения гиповитаминоза.
Витамин В2 хорошо растворим в воде, устойчив в кислой среде, но легко разрушается в нейтральной и щелочной средах, а также под действием УФ-облучения. Для этого витамина характерно функционирование в коэнзимных формах: флавиномононуклео-тид (ФМН) и флавиноадениндинуклеотид (ФАД). Именно на примере выделения рибофлавина в культуральную жидкость было открыто явление сверхсинтеза. При промышленном получении рибофлавина используют культуры дрожжеподобных грибов Eremothecium ashbyii и Ashbya gossipii, синтезирующих до 3,8 и 6,4 г/л рибофлавина соответственно. Однако серьезным недостатком этих культур является их нестабильность при хранении на твердых средах во всем диапазоне температур — от комнатной до температуры лиофилизации, в результате чего они теряют способность к сверхсинтезу рибофлавина. Поэтому для сохранения активности штамма приходится систематически проводить рассев на твердые среды, отбирая колонии с высокой активностью.
Сейчас вместе с вышеуказанными культурами при промышленном получении рибофлавина в помощью методов используется мутантный штамм продуцент Bacillus subtilis с нарушенной регуляцией синтеза витамина В2. Этот штамм устойчив к наиболее сильному антиметаболиту рибофлавина — его аминоаналогу ро-зеофлавину и обладает способностью к сверхсинтезу витамина В2. При культивировании его на среде с мелассой и дрожжевым экстрактом в культуральной жидкости накапливается 3,5 — 4,5 г/л рибофлавина. При этом время ферментации сократилось в 3 раза. Рибофлавин получают и химическим методом, используя в качестве биокатализатора сухие клетки бревибактерий. Причем, если биосинтез с нативными клетками занимает несколько суток, то при биосинтезе с суспензией сухих клеток время синтеза ФАД составляет всего 15—17 ч. важной коферментной формой витамина В3 является кофермент ацетилирования (КоА). Способностью продуцировать в значительных количествах КоА обладают многие микроорганизмы, в частности актиномицеты. Активно внедряются в промышленное производство способы получения пантотеновой кислоты и ее структурных компонентов из р-аланина и пантотеата калия с помощью иммобилизованных клеток бактерий, а также достигнуты существенные успехи при получении КоА с использованием мутант-ных штаммов Brevibacterium ammoniagenes, которые позволяют получать КоА в количестве до 3 г на литр.
Аскорбиновая кислота в мировом промышленном производстве витаминной продукции в целом занимает наибольшую

долю — около 40 тыс. т в год. Ее синтез был разработан швейцарскими учеными А. Грюсснером и С. Рейхштейном в 1934 г. и используется до настоящего времени. Синтез аскорбиновой кислоты является многостадийным химическим процессом, в котором только одна стадия представлена биотрансформацией. Эта стадия трансформации d-сорбита в L-сорбозу при участии ацетатных бактерий. Для получения сорбозы используют глубинную ферментацию, когда культуру продуцента Gluconobacter oxydans выращивают в ферментерах периодического режима с мешалкой и барботером для усиления аэрации и массообмена в течение 20 — 40 ч с результатом по выходу сорбозы до 98% исходного количества сорбита в среде. Обычно для достижения такого высокого выхода целевого продукта в питательную среду вносят кукурузный или дрожжевой экстракт в количестве около 20 %. По окончании ферментации сорбозу выделяют из культураль-ной жидкости. Помимо оптимизации среды можно совершенствовать и технологическую аппаратуру. Например, переход от периодического культивирования продуцента Gluconobacter oxydans к непрерывному в аппарате колоночного типа увеличивает скорость образования сорбозы в 1,7 раз.
В настоящее время широкое использование биотехнологических процессов позволяет совершенствовать синтез аскорбиновой кислоты, сокращая многоэтапные и дорогие химические стадии. Например, синтез витамина С осуществляют енолизацией его важнейшего промежуточного продукта — 2-кето-Ь-гулоно-вой кислоты, которую, в свою очередь, получают методом двух-стадийного микробиологического синтеза, состоящего из окисления d-глюкозы в 2,5-дикето^-глюконовую кислоту (2,5-ДКДГК) и биотрансформации последней в 2-кето-Ь-гулоновую кислоту (2-КГК).
Основными продуктивными микроорганизмами, обеспечивающими процессы окисления d-глюкозы в 2,5-ДКДГК и восстановление последней до 2-КГК, являются мутантные штаммы Erwinia punctata и Corynebacterium sp., при использовании которых выход целевого продукта составляет около 90 % количества глюкозы.
Однако данная технология имеет существенные недостатки, так как при совместном культивировании продуцентов происходит ингибирование синтеза 2-КГК. Поэтому культуральную жидкость после выращивания продуцента 2,5-ДКДГК стерилизуют, применяя поверхностно-активные вещества (ПАВ), что позволяет значительно сократить потери при получении гулоновои кислоты.
Существует и другой биотехнологический способ получения гулоновои кислоты, основанный на синтезе этого продукта штаммом микроорганизмов рода Gluconobacter из сорбозы, производство которой имеет высокую рентабельность. Способность к синтезу целевого продукта обусловлено наличием у этого микроорганизма видоспецифических дегидрогеназ.
Впервые кальциферол был выделен из рыбьего жира в 1936 г. А. Виндаусом и применен при лечении рахита. Он получил название витамина D3, так как ранее из растительных масел был выделен эргостерин под названием витамин D,, при облучении которого получили витамин D2 — эргокальциферол (кальциферол — в переводе «несущий кальций»).
В настоящее время кальциферол производят из эргостерина с применением УФ-облучения биотехнологическим методом. В процессе преобразования эргостерина в эргокальциферол принимают участие микроорганизмы. Особенно богаты эргостерином клетки дрожжей всех видов и плесневые грибы. В сухой биомассе дрожжей содержится 5—10% эргостерина.
В качестве промышленного источника эргостерина используют дрожжи Saccharomyces cerevisiae вследствие высокого содержания в них эргостерина. В анаэробных условиях культивирования происходит накопление в клетках дрожжей сквалена (предшественника эргостерина). Индукция синтеза эргостерина начинается при строго определенной концентрации кислорода от 0,03 до 2 %. При этом среда должна содержать избыток углеводов и малое количество азота. По окончании процесса спиртового брожения дрожжи отделяют от барды и вносят в питательную среду необходимое количество источников углерода, азота и фосфора. Ферментацию ведут в аэробных условиях 12 —20 ч, по окончании которой клетки дрожжей отделяют от культуральной жидкости, добавляют ан-тиоксиданты и сушат. Обычно в такой биомассе содержание эргостерина достигает 1,5%.
При дальнейшем УФ-облучении эргостерина получают витамин D2, который либо используется как пищевая добавка, либо подвергается дальнейшей обработке с целью получения кристаллического витамина D2.

При получении эргостерина из дрожжеподобных грибов рода Candida сухую массу грибов экстрагируют петролейным эфиром для извлечения остаточных углеводородов. Полученная таким образом липидная фракция называется «микробный жир» и является побочным продуктом микробиологической промышленности. Эта фракция может быть использована как источник не только эргостерина, но и убихинона, а также других жирорастворимых соединений. Для грибов рода Candida характерно, что при переходе от периодического культивирования на углеводородах к непрерывному в клетках сохраняются как уровень образования стери-нов, так и относительное содержание в них эргостерина.
Использование отходов крахмало-паточного производства — кукурузного экстракта и зеленой патоки позволяет снизить себестоимость получаемой продукции, а применение в качестве источника углерода целлобиозы, образующейся при утилизации отходов целлюлозы, позволяет в несколько раз увеличить синтез каротиноидов у штаммов культуры Blakslea trispora.
Убихиноны (коферменты Q)
О Н3СО. JL /СН3
Убихиноны в последнее время вызывают интерес как перспективные лечебные препараты. С одной стороны, они синтезируются в организме животных и человека, делая необязательным их поступление с пищевыми продуктами, что отличает их от группы витаминов.
С другой стороны, недостаток убихинонов ведет к нарушениям в обменных процессах, характерных для проявлений недостаточности витаминов групп В и К. Убихиноны являются регуляторами тканевого дыхания, окислительного фосфолирирования в цепи транспорта электронов и за счет высокой специфичности проявляют свой регуляторный эффект.
С практической стороны наибольший интерес вызывают высшие гомологи: убихинон-9 (KoQ9) и убихинон-10 (KoQ|0)- Убихи-нон-10 является коферментом организма человека, вследствие чего на его основе создан лекарственный препарат Ubichynon composi-tum, проявляющий общетонизирующее, антиоксидантное и иммуностимулирующее действие.
В производстве убихинонов применяются биотехнологические методы, в основе которых лежит экстракция KoQ из биологического материала. В промышленном производстве убихинонов в качестве субстрата используются как растительные ткани (каллус риса или опухолевые ткани Carthamus tinctorius), так и микроорганизмы с высоким содержанием убихинонов, например дрожжи Cryptococcus curvatus и грибы Candida maltosa.
В настоящее время используется биотехнология получения уби-хинона-9 и эргостерина из микробных липидов, являющихся побочным продуктом крупного производства белково-витаминного концентрата при выращивании грибов Candida maltosa.
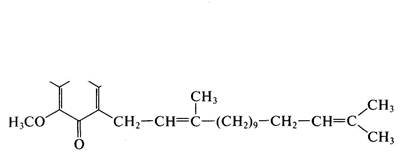
Установлено, что биомасса уксуснокислых бактерий (Gluco-nobacter oxydans), которые используются в производстве аскорбиновой кислоты на этапе окисления d-сорбита в L-сорбозу, содержит значительное количество KoQ,0 без примеси его гомологов. Причем, с одной стороны, эта биомасса является отходом производства аскорбиновой кислоты, с другой стороны, штаммы Gluconobacter oxydans в биомассе характеризуются наибольшей окислительной активностью по сорбиту. Этот уникальный факт позволил разработать и внедрить совместную технологию получения L-сорбозы и экстракции убихинона-10 из отсепарированной биомассы с последующей очисткой и с выходом целевого продукта до 85 %.
Аминокислоты
Все более ухудшающиеся экологические условия создают для населения планеты новую тяжелую проблему — выживание. Одновременно к этой проблеме добавляются такие факторы, как бедность, плохое питание, неуверенность в завтрашнем дне, стрессы. Хорошо изучено благоприятное действие аминокислотных смесей на иммунную систему и различные органы. Помимо этого аминокислоты заменяют насыщенные белком пищевые продукты, недоступные для большинства населения низкоразвитых стран. Таким образом, аминокислоты становятся в настоящее время одним из важнейших факторов выживания населения Земли.
Все 20 аминокислот хорошо изучены (методы их синтеза давно подробно описаны) и являются составными элементами белков или мономерами для построения природных полипептидов. Известно также, что эти соединения существуют в виде оптических изомеров. При этом надо отметить, что аминокислоты в белках находятся в L- и D-формах (L,D-стереоизомеры), причем биологически активны в основном L-формы, а D-стереоизомеры могут быть даже токсичными. Все аминокислоты делятся на незаменимые и заменимые, в зависимости от того, синтезируются они в организме человека или нет. Приблизительно половина из 20 аминокислот являются незаменимыми, а остальные, соответственно, заменимыми.
Незаменимые аминокислоты имеют широкий спектр применения как в сельском хозяйстве (кормовые балансирующие добавки), так в пищевой (биологически активные добавки) и медицинской (лекарственные препараты и смеси для парентерального питания) промышленности.
В сельском хозяйстве аминокислоты используются для балансировки кормов по аминокислотному составу, чтобы в организм животных и птиц они поступали в том соотношении, в каком они находятся в белках этих животных и птиц. Введение аминокислот в корма обеспечивает максимальную скорость синтеза белка и, соответственно, рост биомассы животного. Это очень важно в случае «скороспелого» животноводства, свиноводства и птицеводства.
В питательные продукты для человека также можно добавлять незаменимые аминокислоты. Это целесообразно делать или по медицинским показаниям, или в силу каких-либо соображений, когда человек питается только растительной пишей (растительными белками). Эту пищу можно оптимизировать и улучшить ее питательные свойства, сбалансировав ее по аминокислотному составу путем добавления туда лизина, треонина, метионина (например, в пищу для вегетарианцев). Кроме того, что аминокислоты имеют огромное значение для нашей пищи, они также широко используются и в традиционной клинической практике (табл. 2).
Таблица 2
Моно- и комплексные лекарственные препараты на основе аминокислот
| Препарат | Действие | Применение |
| Глицин | Обладает ноотропным и седативным эффектом; снижает проявления абстиненции у больных алкоголизмом | В клинике нервных и психических заболеваний; в наркологии — для стимуляции умственной деятельности (некоторые студенты проводят терапию глицином перед экзаменами) |
| Глугамин | Обеспечивает формирование высших психических функций; участвует в многообразных реакциях переаминирования, т.е. обеспечивает синтез других заменимых аминокислот; активно связывает образующиеся в процессе метаболических реакций ионы аммония, которые являются токсичными и накопление их в клетках головного мозга вызывает процесс возбуждения | В клинике нервных и психических заболеваний, а также при задержке умственного развития у детей; входит в состав комплексных препаратов для профилактики стресса, например препарат глутамивит наряду с витаминами и микроэлементами содержит также и глутами новую кислоту |
Окончание табл. 2
| Препарат | Действие | Применение |
| Метионин | Является донором метальной группы в разных биохимических реакциях. В частности, при участии метионина осуществляется синтез холина (соединение, входящее в состав клеточных мембран) из жиров; обладает липотропным и гепатропным эффектом | При циррозах и гепатитах печени и лицам преклонного возраста, у которых имеются признаки атеросклероза |
| Цистеин | Приостанавливает процесс помутнения хрусталика | В начальных стадиях развития катаракты; входит в состав глазных капель— витайодурола и др. |
| Тимоген | Иммуностимулирующее; усиливает неспецифическую резистентность организма | Для стимуляции репара-тивных процессов после тяжелых травм (в том числе переломов костей) |
| Цереброли-зин | Регулирует процессы регенерации в головном мозге | После травм головного мозга; инсультов и ише-мического голодания головного мозга, а также при задержке умственного развития у детей |
| Румалон | Корректирует метаболизм костной и хрящевой ткани | При артритах и артрозах |
| Раверон | Регулирует обмен веществ в предстательной железе | Воспалительные болезни и гиперплазия предстательной железы |
| Эмбриобласт | Усиливает метаболические процессы | Для профилактики и коррекции возрастных изменений кожи лица и шеи |
| Препарат NCTC-109 | Создает благоприятную среду для метаболических процессов | Для ускорения заживления и восстановления кожных покровов |
Перечень препаратов на основе аминокислот и их комплексов постоянно растет и расширяется. Очень хорошую перспективу для успешного развития имеют препараты для парентерального питания, содержащие комплексы аминокислот. Они назначаются, когда питание «естественным» образом противопоказано, так как стимулирует секрецию пищеварительных желез. Например, при остром панкреатите человек не должен ни пить, ни есть, поскольку любая стимуляция секреции может привести к самоперевариванию поджелудочной железы.
Тенденция сегодняшнего дня — использование препаратов, содержащих весь комплекс аминокислот (или, по меньшей мере, 18 из них), т.е. в оптимальном для человеческого организма соотношении. В основном это импортные препараты: аминоплазмаль, кетостерил, валин (Германия); аминостерил КЕ (Финляндия); аминосол (Югославия). Некоторые из этих препаратов помимо аминокислот содержат также глюкозу и витамины. Соотношение аминокислот в них оптимальное. В организме человека в зависимости от возраста синтезируются белки соответствующего состава, например аминокислотный состав этих препаратов для детей приближается к составу грудного молока матери, для взрослых он несколько иной.
Установлено, что в любом органе и ткани имеются свои пептиды — соединения, состоящие из небольшого количества аминокислотных остатков, которые образуются и выделяются при их разрушении, стимулируют, как правило, и процессы их регенерации. В соответствии с этим из того или иного органа животных готовят экстракты и на их основе — лекарственные препараты, которые используют для терапии заболеваний этих органов. Общим для всех этих препаратов является то, что действующим началом у них являются пептиды. В частности, в препарате на основе тимуса — тимогене таким действующим началом является глута-милтриптофан (дипептид, состоящий из глутаминовой кислоты и триптофана). Аминокислоты также входят в состав комплексных препаратов, применяемых в косметологии.
Существуют так называемые космоцевтические медицинские препараты, для получения которых используется фармацевтическое сырье, к чистоте которого предъявляют повышенные требования. При этом известно, что особочистыми являются вещества, полученные биотехнологическими методами, например с помощью специально выведенных штаммов-микроорганизмов.
Иллюстрацией может служить препарат эмбриобласт, получаемый из эмбриональной зубной ткани овец, содержащий как биостимуляторы (факторы роста, цитокины и др.), так и необходимый «строительный материал» — аминокислоты, нуклеотиды, витамины, минералы.
В настоящее время аминокислоты получают методами:
• биологическим (применение гидролиза белоксодержащих субстратов);
• химическим (тонкий органический синтез);
• химико-энзиматическим (энзиматическая трансформация химически синтезированных предшественников аминокислот с образованием биологически активных L-изомеров);
• микробиологическим (получение L-аминокислот). Древнейший способ получения аминокислот — кислотный,
щелочной или ферментативный гидролиз белоксодержащих субстратов (мясо, молоко и т.д.). При высокой температуре белок расщепляется на соответствующие аминокислоты или фрагменты, состоящие из нескольких аминокислот. При этом образуется смесь аминокислот и пептидов. Извлечение из этой смеси какой-либо определенной аминокислоты — довольно сложная, но тем не менее выполнимая задача.
Само по себе сырье (мясо и белок молока — казеин) — дорогостоящий продукт, и этот метод применяется, когда имеют дело с «бросовым» сырьем, т.е. с отходами производства (таким сырьем являются рога, копыта, волосы, перья и пух, состоящие из кератина, в котором содержится очень много серосодержащей кислоты цистеина, и — в небольших количествах — других аминокислот).
Следующий способ получения чистых аминокислот — химический синтез. Их синтезируют подобно другим органическим кислотам, это не сложно. Однако в процессе химического синтеза получается смесь D- и L-стереоизомеров (иногда получается и большее количество изомеров), а как известно, в белках человека биологически активны только L-стереоизомеры аминокислот, поэтому существуют трудности разделения этих изомеров. Кроме того, химическое производство аминокислот, как правило, связано с использованием дорогостоящего оборудования и нередко агрессивных токсических соединений в качестве исходного сырья. Процесс протекает при высокой температуре, требует дорогостоящих катализаторов и как всякое химическое производство сопровождается образованием побочных продуктов, загрязняет окружающую среду, небезопасно и небезвредно для обслуживающего персонала.
Тем не менее некоторые аминокислоты получают химическим синтезом, например глицин, а также D-, L-метионин, D-изомер которого малотоксичен, поэтому медицинский препарат на основе метионина содержит D- и L-формы, хотя за рубежом в медицине используется препарат, содержащий только L-форму метионина. Там рацемическую смесь метионина разделяют биоконверсией D-формы в L-форму под влиянием специальных ферментов живых клеток микроорганизмов.
Следующий способ получения аминокислот — химико-энзиматический. Как видно из названия, этот метод получения ами-
нокислот предполагает два этапа. Сначала химическим методом синтезируется «предшественник» — соответствующая карбоновая кислота, а затем эта карбоновая кислота (обычно в присутствии аммиака) превращается в соответствующую аминокислоту. Эта биотрансформация (биоконверсия) осуществляется ферментами живых клеток. Причем полученные L-стереоизомеры аминокислот сами по себе необходимы для жизнедеятельности этих клеток, т.е. фактически этот способ наполовину биотехнологический. Таким методом получают, например, аспарагиновую кислоту (на основе фумаровой кислоты). Раствор фумаровой кислоты пропускают через колонки, в которых иммобилизованы или ферменты, или клетки микроорганизмов с высокой активностью аспартазы, например, Escherichia coli или Serratia marcesceus; туда же подается аммиак и осуществляется биотрансформация.
Аналогичным образом на основе коричной кислоты получают фенилаланин (L-стереоизомер): сн2-сн—соон
используя для этого дрожжевые клетки. Химико-энзиматически можно производить практически все аминокислоты, однако из-за дороговизны и сложности получения соответствующих органических кислот-предшественников этот метод не всегда экономически выгоден и в большинстве случаев уступает методу прямого микробиологического синтеза.
Четвертый способ получения аминокислот — их прямой микробиологический синтез — целиком основан на использовании биообъектов (т.е. является полностью биотехнологическим). В качестве биообъектов в нем применяются штаммы-продуценты аминокислот. Этим методом аминокислоты чаще всего получают на основе Escherichia coli (кишечная палочка — симбионт человека), Bacillus subtilis (сенная палочка — почвенный микроорганизм) и Corynebacterium glutamicum (почвенный микроорганизм).
Все эти микроорганизмы на сегодняшний день прекрасно изучены. Известна полная нуклеотидная последовательность всего их генома. Для кишечной палочки разработаны многообразные способы генетического обмена, позволяющие легко комбинировать разные гены и изменять процесс метаболизма. В меньшей степени это относится к Bacillus subtilis, и еще в меньшей степени к Corynebacterium glutamicum.
Использование этих микроорганизмов для получения аминокислот основано на их способности самостоятельно синтезировать все 20 аминокислот. Также они являются гетеротрофными бактериями, которые в качестве источника углерода используют органические соединения (углевод или какую-нибудь органическую кислоту), а все остальные компоненты получают из неорганических соединений.
Применение микроорганизмов гетеротрофов позволяет суще-; ственно сократить по времени процесс ферментации. Так, кишечная палочка в богатой питательной среде делится каждые 20 — 30 мин, коринебактерии — каждый час. В бедных средах — время регенерации в два раза больше (1 ч для кишечной палочки, 1,5 — 2 ч для коринебактерии и сенной палочки).
Вместе с тем существуют бактерии, так называемые ауксо-трофные мутанты — микроорганизмы, которые, с одной стороны, утратили способность самостоятельно синтезировать необходимые для построения всех компонентов своей клетки разные аминокислоты, а с другой — приобрели способность к сверхсинтезу целевой аминокислоты. Такие мутанты получают либо воздействием различных мутагенов физической и химической природы на исходную культуру микроорганизма с последующей селекцией штамма по заранее заданным признакам, либо методами генной инженерии.
Известно, что клетки бактерий синтезируют аминокислоты для удовлетворения собственных потребностей (синтез белка и другие метаболические процессы); синтезируется их в клетках бактерий определенное количество. В процессе эволюции (естественного отбора) выживали только те формы, в которых метаболические процессы протекали наиболее экономно, и это обеспечивалось за счет механизмов регуляции этих процессов.
Известно, что в регуляции и управлении метаболическими процессами используется принцип обратной связи. Существуют два уровня (механизма) регуляции биосинтеза конечного (целевого) продукта — ретроингибирование и репрессия. На первом уровне образующаяся в цепи последовательных реакций аминокислота ингибирует активность одного из начальных ферментов собственного синтеза. Если этого механизма недостаточно и конечный продукт (аминокислота) все равно присутствует в избытке, то включается второй механизм регуляции и в результате по* давляется (репрессируется) образование всего комплекса ферментов соответствующей биосинтетической цепи. На примере биосинтеза аминокислоты треонина:
НО NH2 II СН3СНСНСООН
можно показать, как реализуются эти принципы в клетках кишечной палочки. Треонин, а также лизин и метионин относятся к семейству аспарагиновой кислоты. В клетках бактерий сначала синтезируется аспарагиновая кислота:
NH2 I НООС-СН2-СН-СООН
а затем на ее основе синтезируются треонин, метионин и лизин (поэтому они и объединены в семейство аспарагиновой кислоты). Синтез каждой из этих аминокислот осуществляется в несколько этапов с образованием промежуточных соединений. Каждый из этих этапов катализируется белком-ферментом, синтез которого контролируется (кодируется) соответствующим геном, в нуклеотидной последовательности которого записана структура этого белка.
Первая реакция синтеза этих аминокисл