I. Вступительная часть: Сформулировать цели и задачи занятия, подготовить титульный лист отчета.
II. Основная часть:
Первый учебный вопрос: Получение сложных эфиров
Второй учебный вопрос: Свойства эфиров
Контрольные вопросы
1. Дайте определение сложных эфиров. Напишите их общую формулу.
2. Напишите уравнение реакции получения а) этилацетата, б) метилформиата.
3. Дайте определение реакции этерификации.
4. Что такое омыление? Напишите уравнение реакции щелочного гидролиза этилацетата.
5. Дайте определение жиров. Составьте уравнение синтеза жира.
6. Напишите уравнение реакции гидролиза жира в щелочной среде.
7. Сравните свойства мыла и синтетических моющих средств. Что такое мыло? (Химическое определение.)
1. Получение сложных эфиров
Цель работы:
Получение эфиров и исследование их свойств.
Постановка задачи:
1.Омыление жиров.
2.Сравнение свойств мыла и синтетических моющих средств.
Важнейшими производными карбоновых кислот являются сложные эфиры. Их получают взаимодействием кислот со спиртами.
Определение: К сложным эфирам относятся органические вещества, которые образуются в реакциях органических кислот со спиртами, идущими с отделением воды.
Этерификация - реакция образования сложных эфиров из карбоновых кислот и спиртов.
Общая формула сложных эфиров:
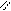

 O
O
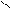

 R C
R C
OR1
R и R1 - радикалы углеводородов, одинаковые или разные.
В общем виде реакцию образования эфира (реакция этерификации) можно представить так:


 R-COOH + HO-R1
R-COOH + HO-R1 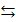 R- COO R1 + H2 O
R- COO R1 + H2 O
Реакция образования эфира носит название реакция этерификации. (От лат. aether – эфир) Эта реакция протекает медленно, поэтому обычно ее проводят в присутствии сильных неорганических кислот (чаще всего серной), ускоряющей реакцию. Каталитическое действие здесь оказывают ионы водорода.
|
|
В процессе реакции этерификации выделяется вода. За счет чего она образуется? Можно было бы предположить, что молекулы органической кислоты будет отщепляться атом водорода, как наиболее протонизированный, а от молекулы спирта - гидроксильная группа. В течение многих лет считали, что эфиры именно так образуются, и только применение изотопов позволило установить истину. Для доказательства реакцию этерификации органической кислоты проводили с метиловым спиртом, в котором содержался изотоп кислорода 18O. Исследования показали, что в результате реакции тяжелый атом кислорода оказался в сложном эфире.
При взаимодействии органической кислоты со спиртом гидроксильная группа отщепляется от кислоты, а водород от спирта.
Название сложных эфиров составляют из названий кислот и спиртов, остатки которых входят в состав молекулы эфира. По систематической номенклатуре сложные эфиры называют, прибавляя в качестве приставки название спиртового радикала к названию кислоты, в которой окончание - овая заменяют на окончание – ат.
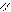
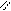 O O
O O
H – C CH3– C

 O – C2H5 O – CH3
O – C2H5 O – CH3
Этиловый эфир муравьиной кислоты метиловый эфир уксусной
или этилформиат кислоты или метилацетат
В природе сложные эфиры содержатся в цветах, фруктах, ягодах и определяют их специфический запах.
Сложные эфиры простейших одноосновных кислот и спиртов – жидкости легче воды, летучие и обладают приятным запахом.
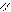
 Например: O
Например: O
|
|


 CH3– C
CH3– C
 O– C H2– C H2 – CH– C H3
O– C H2– C H2 – CH– C H3
│
CH3
 Изопентилацетат – запах груш, бутиловый эфир масляной кислоты – ананасов.
Изопентилацетат – запах груш, бутиловый эфир масляной кислоты – ананасов.
Некоторые сложные эфиры в виде фруктовых эссенций получают искусственно, например грушевую эссенцию (изоамиловый эфир уксусной кислоты и изоамилового спирта (3-метилбутанола-1)) и.т.д. Фруктовые эссенции используются в парфюмерии, приготовлении фруктовых вод и кондитерских изделий. Этилацетат и изоамилацетат применяются в качестве растворителей. Значительные количества этилацетата идут для синтеза различных веществ, в том числе лекарственных.
Свойства эфиров
Наиболее важным химическим свойством сложных эфиров является реакция с водой – гидролиз. Протекает она в кислой или щелочной среде, а также в присутствии ферментов. В результате гидролиза сложных эфиров получают карбоновую кислоту и спирт:
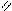 O H+
O H+
 CH3– C + H2O → CH3– COOH + C2H5OH
CH3– C + H2O → CH3– COOH + C2H5OH
O – C 2H5
Этилацетат уксусная кислота
 Такое превращение является обратным реакции этерификации. Ионы водорода катализируют как прямую реакцию (эфирообразование) так и обратную (гидролиз). Химическое равновесие наступает тогда, когда скорость прямой реакции будет равна скорости обратной. Когда необходимо подвергнуть эфир необратимому гидролизу, реакцию проводят в присутствии щелочи, что позволяет «связать» образующую кислоту превращением её в соль, а соль не реагирует со спиртом. Это реакция омыления. Применяются сложные эфиры в качестве добавок при производстве освежающих напитков, конфет и других пищевых продуктов, а также в парфюмерии. Метилакрилат и метилметакрилат широко используются в производстве пластмасс. Полиметилметакрилат – органическое стекло.
Такое превращение является обратным реакции этерификации. Ионы водорода катализируют как прямую реакцию (эфирообразование) так и обратную (гидролиз). Химическое равновесие наступает тогда, когда скорость прямой реакции будет равна скорости обратной. Когда необходимо подвергнуть эфир необратимому гидролизу, реакцию проводят в присутствии щелочи, что позволяет «связать» образующую кислоту превращением её в соль, а соль не реагирует со спиртом. Это реакция омыления. Применяются сложные эфиры в качестве добавок при производстве освежающих напитков, конфет и других пищевых продуктов, а также в парфюмерии. Метилакрилат и метилметакрилат широко используются в производстве пластмасс. Полиметилметакрилат – органическое стекло.
|
|
Жиры – это сложные эфиры глицерина и карбоновых кислот. Жиры играют исключительно важную биологическую роль в жизни животного и растительного мира. Они являются ценными пищевыми продуктами.
В образовании сложных эфиров, входящих в состав жира, могут принимать участие разные высшие карбоновые кислоты, но из спиртов только один – глицерин. Поэтому эти эфиры называют глицеридами (ацилглицеринами). Общая формула жиров имеет вид:
H2C-O - C-O – R’
│
HC-O- CO – R’’
│
H2C-O - C-O – R’’’
Где R’, R’’ и R’’’ –радикалы высших карбоновых кислот, входящих в состав жира. Синтез жира идет согласно уравнению:
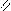
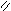 O O
O O
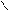

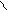

 HO- C CH 2 - O - C
HO- C CH 2 - O - C
 CH 2 - OH R1 │ R1
CH 2 - OH R1 │ R1
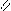
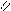

 O O
O O
 CH - OH + HO - C
CH - OH + HO - C 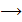 CH - O - C + 3H2O
CH - O - C + 3H2O
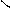

 R2 │ R2
R2 │ R2
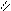
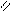 O O
O O
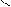
 CH2 - OH HO- C CH2 - O - C
CH2 - OH HO- C CH2 - O - C
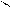 R3 R3
R3 R3
Жиры могут быть твердые или жидкие. Жидкие жиры называют маслами. Твердые жиры в основном животного происхождения, жидкие растительного.
Жиры легче воды и в воде не растворяются, но растворяются в органических растворителях – бензине, бензоле и др.
Твердые жиры образованы высшими предельными карбоновыми кислотами – в основном C17H35COOH(стеариновой), C15H31COOH (паль-митиновой).
Жидкие жиры образованы, главным образом, высшими непредельными карбоновыми кислотами – олеиновой.C17H33COOH, линолевой. C17H31COOH и линоленовой. C17H29COOH.
Температура плавления жиров зависит от состава остатков кислот. С повышением количества остатков непредельных кислот температура плавления жиров понижается.
Жиры наряду с углеводородами и белками являются важной составной частью пищи человека и животных. Жиры в организме под действием ферментов подвергаются гидролизу.
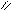
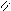 O O
O O
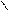
 . CH 2 – O - C HO - H CH 2 OH R1- C
. CH 2 – O - C HO - H CH 2 OH R1- C
R1 │ OH
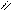
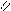 O ферменты O
O ферменты O
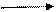
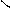
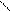 . CH - O - C + HO – H CH – OH + R2- C
. CH - O - C + HO – H CH – OH + R2- C
R2 │ OH
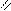
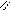 O O
O O
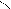
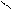 CH 2 – O - C HO - H CH 2 OH R3 - C
CH 2 – O - C HO - H CH 2 OH R3 - C
R3 OH
Продукты гидролиза – глицерин и карбоновые кислоты всасываются ворсинками кишечника, и снова образуется жир, необходимый данному организму.
Жиры взаимодействуют также со щелочами, происходит их омыление.
В промышленности гидролиз жиров проводят с целью получения глицерина, карбоновых кислот, мыла. Кроме реакции гидролиза, жидкие жиры, содержащие остатки непредельных кислот, способны к реакции гидрирования.
В результате гидрирования получается твердая масса – саломас. Его подвергают вначале очистке, а затем используют для производства мыла и маргарина.
Процесс гидрирования позволяет превратить малоценные и дешевые масла в более ценные твердые жиры. Кроме того, гидрирование жидких жиров предохраняет их от быстрой порчи (твердые жиры лучше сохраняются). Жидкие жиры характеризуются еще одним свойством: при хранении они окисляются за счет двойных связей льняное, маковое, конопляное и др.). Такие масла при окислении на воздухе образуют прозрачную высыхающую пленку. Чем меньше в масле остатков ненасыщенных кислот, тем меньше степень высыхания масла (подсолнечное, соевое, хлопковое масла).
Из масел готовят олифы, используемые для разведения густотертых красок, шпаклевок. В медицине жиры используются для в качестве основы для приготовления мазей, растирок (на подсолнечном масле). Многие масла применяются для растворения лекарственных средств (например, камфару растворяют в оливковом масле).
 |
Опыт № 1
«Получение мыла из жиров »
Оборудование:
Электроплитка с закрытой спиралью, химический стакан с V=50 мл, пипетка, коническая воронка, стеклянная палочка, 3 пробирки, фильтровальная бумага.
Реактивы:
Животный жир (свиной), 40% раствор гидроксид натрия, насыщенный раствор поваренной соли, 0,5 мл раствора сульфата меди (II), раствор серной кислоты(1:5) дистиллированная вода.
В стакан положите 1 г. жира, прилейте 3мл раствора гидроксид натрия и нагрейте на слабом огне (15-20мин). Когда смесь закипит, прилейте 1-1.5 мл воды. При вспенивании жидкости прилейте снова столько же воды и продолжайте нагревание.
Внешним признаком закончившегося гидролиза жира является появление на поверхности жидкости и на стенках стакана мелких желтых кусочков мыла. Чтобы убедиться, что гидролиз окончен, отберите пипеткой из стакана 5 капель жидкости и внесите в сухую пробирку. К пробе добавьте каплю раствора соли меди (для обнаружения глицерина) Поскольку среда сильно щелочная, то появление ярко-синей окраски раствора показывает, что гидролиз закончился. Если окраска не появляется, продолжайте нагревание.
Установив окончание процесса гидролиза, прекратите нагревание, снимите стакан с плитки и дайте ему остыть. Через несколько минут прилейте в стакан 5мл насыщенного раствора поваренной соли (для выделения мыла). Профильтруйте раствор. Не вынимая фильтр, промойте мыло от щелочи 2 мл дистиллированной воды.
1.Исследуйте фильтрат, докажите что в нем содержится глицерин, щелочь.
2.Докажите образование мыла. Для этого растворите кусочек мыла в дистиллированной воде и взболтайте смесь. Что наблюдается?
3.В другую пробирку отлейте 1-1,5 мл раствора мыла и добавьте 0,5 мл раствора серной кислоты. Составьте уравнение реакции.
Мыла
Мыла - соли высших карбоновых кислот. Их общая формула: (R – СOO) п Мп+ где Мп+ ион металла. Синтетические моющие средства имеют более сложный состав. Сырьем для их получения являются продукты переработки нефти, например парафин. При его окислении образуются жирные кислоты (C10- C20)Один из видов синтетических моющих средств получают по следующей схеме:
Жирные спирты реагируют с серной кислотой с образованием сложного эфира
(алкилсерной кислоты):
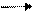 R-CH2-OH + H –O-SO3H R-CH2- O-SO3H + H2O
R-CH2-OH + H –O-SO3H R-CH2- O-SO3H + H2O
Сложный эфир обрабатывают гидроксидом натрия, и получается натриевая соль алкилсерной кислоты – алкилсульфат Na
 R-CH2-O- SO3H + Na OH R-CH2- O-SO3 Na + H2O
R-CH2-O- SO3H + Na OH R-CH2- O-SO3 Na + H2O
Моющие средства содержат различные добавки, способствующие устранению моющего действия (сода, фосфаты и др.), стабилизаторы пены, отбеливатели. Некоторое сходство синтетических моющих средств с мылом заключается в том,что их молекулы также имеют неполярную часть(углеводородный радикал, содержащий от 10 до 20 атомов углерода и полярную часть (например, группу -SO3 Na).Поэтому они, как и мыло, обладают хорошим моющим действием. Однако есть и свойства, отличающие их от мыл.
Опыт № 2
«Сравнение свойств мыла и синтетических моющих средств»
Оборудование:
Штатив, 4 пробирки.
Реактивы:
1% растворы хозяйственного мыла синтетического порошка «Лотос», «Кристалл», приготовленный на дистиллированной воде, жесткая вода, раствор серной кислоты(1:5) или соляной (1:3) кислоты.
1. В 2 пробирки налейте по 1мл жесткой воды. В каждую пробирку добавляйте по каплям: в 1-ю раствор мыла, во 2-ю раствор порошка. Не забудьте после каждой капли взбалтывать жидкость.
а) в каком случае приходится прибавлять больше раствора мыла или синтетического порошка для образования устойчивой пены?
б) какое моющее средство не утрачивает своего действия в жесткой воде?
2. В 2 пробирки налейте по 1мл: в 1-ю раствор мыла, во 2-ю раствор синтетического порошка. В пробирки внесите несколько капель раствора серной или соляной кислоты.
Ответьте на вопросы:
1. Дайте пояснение, что вы наблюдаете?
2. Составьте уравнение реакции для раствора мыла.
Опыт № 3
«Эмульгирующее действие мыла»
Очищающее (моющее) действие мыла обусловлено тем, что оно эмульгирует масла и другие загрязнения. Действие мыла заключается в следующем. Молекулы мыла состоят из неполярного углеводородного радикала R и полярной группы – СOO -- . Адсорбируясь на поверхности частиц твердых загрязнений или капель масла, они располагаются строго упорядоченно: углеводородные радикалы направлены внутрь, а группы– СOO— остаются снаружи, т.е. образуется мицелла мыла (рис.1).
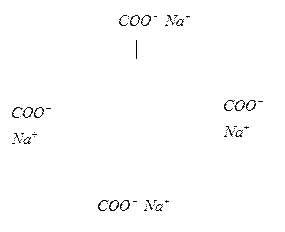


Рис.1Образование мицеллы мыла.
На поверхности частиц (капель масла) возникает адсорбционный слой, заряженный отрицательно. Это способствует отрыву частиц загрязнений от поверхности ткани и переходу их в моющую жидкость. Одноименный заряд частиц препятствует их слипанию и объясняет устойчивость эмульсии.
Оборудование: пробирки.
Реактивы: Подсолнечное масло, дистиллированная вода, раствор мыла.
Внесите в 1-ю пробирку каплю растительного масла, 5 капель дистиллированной воды и энергично встряхните.
Во 2-ю пробирку внесите каплю растительного масла, 5 капель дистиллированной воды, 5 капель раствора мыла.
Ответьте на вопросы:
1. Что наблюдается в пробирках?
2. Объясните, почему во 2-й пробирке эмульсия более устойчивая?
Опыт № 4
«Гидролиз мыла»
Оборудование:
Электроплитка, химический стакан вместимостью 100мл, стеклянная
палочка, фильтровальная бумага, большой химический стакан.
Реактивы:
Мыло, раствор соляной кислоты(1:1), дистиллированная вода, раствор
фенолфталеина.
Возьмите кусочек мыла (1,5г.) нарежьте на тонкие полоски и поместите их в химический стакан. К мылу добавьте 15мл дистиллированной воды и нагревайте стакан со смесью на электроплитке до полного растворения мыла.
Затем прилейте 3 мл соляной кислоты, поместив предварительно стеклянную палочку в стакан, и продолжайте осторожно нагревать на слабом огне до образования 2-х слоев.
Дайте стакану остыть, затем поставьте его в сосуд с холодной водой. Когда верхний слой кислот застынет, выньте палочку из стакана и через образовавшееся отверстие слейте жидкость. Жирные кислоты перенести палочкой на фильтровальную бумагу. Добавьте к слитой жидкости несколько капель раствора фенолфталеина.
1.Составьте уравнение реакции гидролиза мыла (стеарата натрия)
2.Какую реакцию имеет водный раствор мыла?
Контрольные вопросы:
1.Что такое сложные эфиры? Запишите общую формулу сложных эфиров.
2.Напишите уравнение реакции получения этилацетата, метилформиата.
3.Дайте определение реакции этерификации.
4.Охарактеризуйте важное химическое свойство сложных эфиров (омыление). Напишите реакцию гидролиза этилацетата.
5. Дайте определение жиров. Составьте уравнение синтеза жира.
6.Напишите уравнение реакции гидролиза жира в щелочной среде (омыление)
7.Сравните свойства мыла и синтетических моющих средств (сходство и различие).
III. Заключительная часть:
Оценить работу группы.
Задание на СП:
Подготовиться к защите лабораторной работы.