Второе начало термодинамики. Энтропия.
Второе начало термодинамики: теплота не может переходить от менее нагретого тела к более нагретому телу.
Энтропия S - отношение теплоты к температуре, при которой происходит переход энергии S = Q/T Дж/моль К.
Энтропия по Больцману: S = k · ln W, где W - вероятность состояния данной системы,
k – const Больцмана.  ;ΔSпл = ΔHпл/Tпл. Изменение энтропии в хим превращениях вычисляется по формуле:
;ΔSпл = ΔHпл/Tпл. Изменение энтропии в хим превращениях вычисляется по формуле:  где νj, νi - стехиометрические коэффициенты в уравнении химической реакции.
где νj, νi - стехиометрические коэффициенты в уравнении химической реакции.
Энтропия зависит от:
Агрегатного состояния вещества. Энтропия увеличивается при переходе от твердого к жидкому и особенно к газообразному состоянию. Изотопного состава. Молекулярной массы однотипных соединений. Строения молекулы. Кристаллической структуры.
Существует примерно 40 формулировок 2-го закона термодинамики:
1. Постулат Клаузиуса (немец Рудольф Клаузиус). "Единственным результатом любой совокупности процессов не может быть переход теплоты от тела менее нагретого к более нагретому."
2. Постулат Томсона Кельвина. Процесс, единственным результатом которого является превращение теплоты в работу, невозможен.
3. В изолированной системе самопроизвольно протекают только те процессы, которые сопровождаются увеличением энергии.
В самопроизвольном процессе DS > 0 (обладают все реальные системы)
В равновесном процессе DS = 0;
В не самопроизвольном процессе DS < 0. Положительной энтропией
Энергия Гиббса, Гельмгольца. Критерии направленности химических процессов.
Для общего случая обратимых и необратимых процессов можно объединить 1 и 2 законы термодинамики:
Из 1 закона: dQ = dU +dA.
Из 2 закона: dQ= TdS, поэтому TdS = dU + dA следует dA = TdS - dU. После преобразований:
U - TS = F,поэтому:AV =-(F2 - F1)
F - новая функция состояния, называемая энергией Гельмгольца (свободная энергия при постоянном объеме системы или изохорно-изотермический термодинамический потенциал).
Величина АР = AV - p есть величина максимальной полезной работы, где АV - максимальная полная работа. По аналогии АР может быть определена в виде разности двух значений некоторой функции G - энергии Гиббса: ΔG = ΔH – TΔS ΔG0298 кДж/моль ΔG0298 = ΔH0 298 – TΔS0298
При ΔG < 0 реакция термодинамически разрешена и система стремится к достижению условия ΔG = 0, при котором наступает равновесное состояние обратимого процесса; ΔG > 0 указывает на то, что процесс термодинамически запрещен.
Если ΔH < 0 и ΔS > 0, то всегда ΔG < 0 и реакция возможна при любой температуре.
Если ΔH > 0 и ΔS < 0, то всегда ΔG > 0, и реакция с поглощением теплоты и уменьшением энтропии невозможна ни при каких условиях.
В остальных случаях (ΔH < 0, ΔS < 0 и ΔH > 0, ΔS > 0) знак ΔG зависит от соотношения ΔH и TΔS.
Для оценки знака ΔG реакции важно знать величины ΔH и ΔS наиболее типичных процессов. ΔH образования сложных веществ и ΔH реакции лежат в пределах 80–800 кДж∙моль-1. Энтальпия реакции сгорания  всегда отрицательна и составляет тысячи кДж∙моль-1. Энтальпии фазовых переходов обычно меньше энтальпий образования и химической реакции
всегда отрицательна и составляет тысячи кДж∙моль-1. Энтальпии фазовых переходов обычно меньше энтальпий образования и химической реакции  – десятки кДж∙моль-1,
– десятки кДж∙моль-1,  и
и 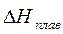 равны 5–25 кДж∙моль-1.
равны 5–25 кДж∙моль-1.
УРАВНЕНИЕ ГИББСА-ГЕМГОЛЬЦА:
Функции F и G - надежный критерий оценки возможности, направления и пределов протекания естественных процессов в неизолированных системах.
уравнение Гиббса - Гельмгольца: 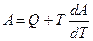 , где
, где  - температурный коэффициент работы.
- температурный коэффициент работы.