Для односубстратных ферментативных процессов простейшей является схема предложенная Бриггсом и Холдейном:
Кинетический анализ данной схемы, представленный ниже, приводит к основополагающему уравнению ферментативной кинетики. В классическом варианте взаимодействие фермента с продуктом с образованием комплекса ЕР, не учитывается. Очевидно, что скорость ферментативной реакции пропорциональна концентрации фермент-субстратного комплекса (ES). Используя основной постулат химической кинетики и принцип аддитивности, можно записать уравнения для скорости образования (V обр) и расходования (V расх) комплекса ES. В условиях стационарного (квазистационарного) режима протекания процесса изменения концентрации ES в системе не происходит, следовательно, V обр = V расх.


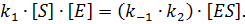
|
Разделяя постоянные и переменные параметры, приходим к уравнению:
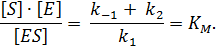
| (1) |
Во время реакции фермент в системе существует в двух формах – в свободной (E) и в форме фермент-субстратного комплекса (ES):
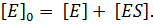
|
Экспериментально определить концентрацию свободной формы фермента [Е] практически невозможно. Ее можно выразить через известные параметры:
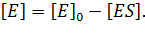
|
После преобразований, получаем
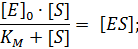
| (2) |
Определить стационарную концентрацию комплекса ES возможно при помощи селективного ингибитора: 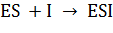 , но эта процедура имеет существенную экспериментальную сложность. Возникает необходимость выразить [ES] с помощью других кинетических параметров.
, но эта процедура имеет существенную экспериментальную сложность. Возникает необходимость выразить [ES] с помощью других кинетических параметров.
Очевидно, что скорость ферментативной реакции будет пропорциональна стационарной концентрации ES. Предположив, что реакция распада комплекса ES с образованием продукта является скоростьлимитирующей, получаем скорость ферментативного процесса:
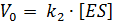 . .
| (3) |
Экспериментальная зависимость начальной скорости реакции от концентрации субстрата имеет вид кривой с насыщением, изображенной на рисунке 1.
| ||||||
| Рисунок 1 – График зависимости начальной скорости от концентрации в координатах уравнения Михаэлиса-Ментен. |
Данный вид кривой объясняется тем, что любой фермент имеет предельную скорость превращения субстрата в продукт, которая характеризуется оборотностью фермента. Например, значение оборотности каталазы составляет примерно 40 000 молекул. Это означает, что 40 тыс. молекул Н2О2 разлагается одной молекулой фермента за одну секунду.
Рассмотрим следующий пример. При соотношении [S]0/[E]0 = 1, стационарная концентрация свободной формы фермента Е будет значительно выше стационарной концентрации комплекса ES. Допустим, 97% от [E]0 составляет [E], а 3% - [ES]. Если соотношение увеличивается (начальная концентрация субстрата выше), то стационарная концентрация Е уменьшается, а ES – увеличивается. При очень большом значении соотношения [S]0/[E]0 в реакционной смеси концентрация [ES] будет приближаться к 100% от [E]0, а E будет практически отсутствовать. Дальнейшее увеличение концентрации субстрата не будет приводить к увеличению [ES], а значит, и скорости ферментативного процесса. Это значит, что есть предельная скорость ферментативной реакции и она равна:
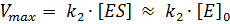 . .
| (4) |
Подставим (3) и (4) в уравнение (2) и выполним преобразования, выразив V0, п олучаем уравнение (5) – уравнение Михаэлиса-Ментен.
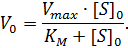
| (5) |
Как видно, это уравнение включает два переменных параметра – начальную концентрацию субстрата S0, которая известна по условиям опыта, и начальную скорость V0, которая должна быть достоверно определяема используемым методом, и два константных. Следует отметить, что так как одним из условий применимости уравнения Михаэлиса-Ментен является постоянство концентрации субстрата, кинетику исследуют на начальном этапе превращения, при малой степени превращения субстрата, когда его концентрация еще может считаться неизменной.
Константы, входящие в уравнение, КM и Vmax, могут быть определены при обработке массива известных кинетических данных (зависимости V0 от [ S ] 0), о чем пойдет речь дальше.
Vmax по определению равна скорости реакции при насыщении субстратом всех молекул фермента, то есть, это максимальная скорость при данной концентрации фермента в исследуемых условиях. Ее размерность совпадает с размерностью начальной скорости, входящей в уравнение, например, моль (л∙с)-1.
KM – константа Михаэлиса имеет размерность концентрации и равна такой концентрации субстрата, при которой скорость реакции равняется половине максимальной:
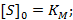
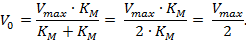
|
Очевидно, что величина KM зависит от соотношения констант скорости элементарных стадий (см. уравнение 1). Рассмотрим предельные случаи.
1) 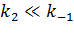
Равновесие на первой стадии устанавливается намного быстрее протекания второй стадии. В выражении для константы Михаэлиса можно пренебречь 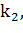 скорость процесса в целом определяется KS = k-1/k1 – константой равновесия, константой диссоциации фермент-субстратного комплекса. Очевидно, что чем она выше, тем ниже скорость:
скорость процесса в целом определяется KS = k-1/k1 – константой равновесия, константой диссоциации фермент-субстратного комплекса. Очевидно, что чем она выше, тем ниже скорость:

|
2) 
Если вторая стадия ферментативного процесса существенно быстрее распада фермент-субстратного комплекса, то  в уравнении (1) можно пренебречь и константа Михаэлиса трансформируется в кинетическую константу Kk = k2/k1 , характеризующую соотношение скоростей образования и расходования фермент-субстратного комплекса.
в уравнении (1) можно пренебречь и константа Михаэлиса трансформируется в кинетическую константу Kk = k2/k1 , характеризующую соотношение скоростей образования и расходования фермент-субстратного комплекса.

|
3) 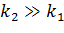
В ситуации, когда вторая стадия существенно быстрее первой, нельзя говорить о квазистационарной концентрации ES и рассматриваемый подход оказывается некорректным.
Если же соотношение констант таково, что пренебречь никакой из них нельзя, используют константу Михаэлиса без изменений.
Уравнениями, совпадающими по форме с уравнением Михаэлиса-Ментен, могут описываться и более сложные случаи кинетики, не соответствующие схеме Бриггса-Холдейна. Тогда выражения для КM и Vmax имеют более сложный вид.
Физический смысл констант уравнения Михаэлиса-Ментен.
По аналогии с KS, KM можно рассматривать как меру сродства субстрата к ферменту.
Vmax характеризует оборотность фермента. Действительно, более высокая скорость при одной и той же концентрации фермента будет наблюдаться в том случае, если фермент превращает больше молекул субстрата в единицу времени. Но максимальная скорость зависит и от концентрации, и использовать ее для сравнения разных ферментов может быть неудобно. Поэтому вводят каталитическую константу 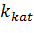
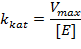
|
В простейшем случае она совпадает с  .
.
Если концентрация фермента дана в моль/л (для чего необходимо знать его молекулярную массу), а скорость определена в моль (л∙с)-1:

То есть, данная константа численно характеризует оборотность фермента.
Так как Vmax и KM являются константами, их используют для того, чтобы характеризовать активность ферментов.