Практическоезанятие № 5
Расчет разбавленных растворов
Цель: научиться определять температуру замерзания криоскопическим методом и температуру кипения эбуллиоскопическим методом, используя закон Рауля определить давление.
Методические указания.
Общими являются свойства растворов, которые зависят от концентрации и практически не зависят от природы растворенных веществ. Такие свойства могут проявляться в полной мере в идеальных растворах. Идеальным называют раствор, в котором не происходят химические реакции между компонентами, а силы межмолекулярного взаимодействия между компонентами одинаковы. Соответственно, образование этих растворов не сопровождается тепловым эффектом (ΔН =0) и каждый компонент ведет себя в растворе независимо от других компонентов. К идеальным растворам по своим свойствам приближаются лишь очень разбавленные растворы, т.е. растворы с очень низкой концентрацией растворенного вещества.
Закон Рауля. Молекулы нелетучего растворенного компонента раствора препятствуют улетучиванию из раствора молекул растворителя. Французский ученый Р. Рауль открыл закон, согласно которому понижение давления насыщенного пара растворителя А над раствором ΔрА пропорционально молярной доле растворенного нелетучего вещества хВ:
р0А – рА = ΔрА= р0АхВ,
где р0А, рА – давления насыщенного пара растворителя соответственно над чистым растворителем и над раствором; ΔрА – разность между давлениями насыщенного пара растворителя над раствором, рА и растворителем р0А. Т.е. с увеличением содержания нелетучего растворенного компонента давление пара растворителя над раствором уменьшается.
Из закона Рауля возникают два следствия. Согласно одному из них температура кипения раствора выше температуры кипения растворителя. Это обусловлено тем, давление насыщенного пара растворителя над раствором становится равным атмосферному давлению (условие кипения жидкости) при более высокой температуре, чем в случае чистого растворителя. Повышениетемпературы кипения ΔТкип пропорционально моляльности раствора ст
ΔТкип = Кэст,
где Кэ – эбулиоскопическая постоянная растворителя.
Согласно второму следствию из закона Рауля температура замерзания (кристаллизации) раствора ниже температуры замерзания (кристаллизации) чистого растворителя. Это обусловлено более низким давлением пара растворителя над раствором, чем над растворителем. Понижение температуры замерзания (кристаллизации)
ΔТзам = Ккст,
где Кк – криоскопическая постоянная.
Значения Кэ и Кк зависят от природы растворителя.
Используя ΔТкип и ΔТзам, можно определить молярную массу вещества. Для этого экспериментально определяют повышение температуры кипения или замерзания раствора. Если известна масса растворенного вещества тВ и растворителя тА, то молярную массу растворенного вещества МВ определяют по уравнению
МВ = 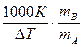 ,
,
Осмотическое давление. Самопроизвольный переход растворителя через полупроницаемую мембрану, разделяющую раствор и растворитель или два раствора с различной концентрацией растворенного вещества, называется осмосом. Осмос обусловлен диффузией молекул растворителя через полупроницаемую перегородку, которая пропускает только молекулы растворителя.
Осмотическое давление возрастает с увеличением концентрации растворенного вещества и температуры. Вант-Гофф предположил, что для осмотического давления можно применить уравнение состояния идеального газа
πV = nRT или π = 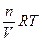 ,
,
откуда π =cRT,
где π – осмотическое давление; с – молярная концентрация раствора.
Пример 1. Определите температуру кипения раствора, содержащего 1,84г нитробензола C6N5NO2 в 10 г бензола. Эбуллиоскопическая постоянная бензола 2,53. Температура кипения чистого бензола 80,20С.
Решение
По закону Рауля 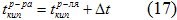 ,
,
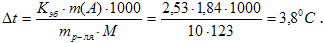
Температура кипения раствора: 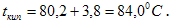
Пример 2. Раствор, содержащий 1,22 г бензойной кислоты C6H5COOH в 100 г сероуглерода, кипит при 46,529 0С, температура кипения сероуглерода 46,3 0С. Вычислите эбуллиоскопическую константу сероуглерода.
Решение
Повышение температуры кипения ∆t = 46,529 – 46,3 = 0,2290. Молярная масса бензойной кислоты 122 г/моль. Из формулы (1) находим эбуллиоскопическую константу:
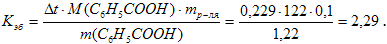
Пример 3. Раствор, содержащий 11,04 г глицерина в 800 г воды, кристаллизуется при –0,2790C. Вычислить молярную массу глицерина.
Решение
Температура кристаллизации чистой воды 00С, следовательно, понижение температуры кристаллизации ∆t = 0 – (– 0,279) = 0,2790.Подставляя в уравнение (1) данные вычисляем молярную массу глицерина:
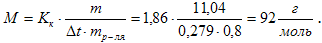
Пример 4. Вычислить упругость пара над 10%-ным раствором фенола, если упругость пара над чистым растворителем р 0 = 2,26 ∙ 103 Па.
Решение
р = р 0(1 - N ф), N ф – мольная доля фенола.
Пересчитываем концентрацию раствора:
Nфенола = 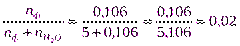 .
.
Для расчета удобно взять 100 г раствора:
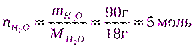 (в 100 г раствора);
(в 100 г раствора);
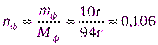 ;
;
Мф (С6Н5ОН) = 6 ∙ 12 + 5 ∙ 1 + 16 ∙ 1 + 1 ∙ 1 = 94 г;
р = 2,26 ∙ 103 ∙ 0,98 =2,24 ∙ 103 Па.
Пример5 Определить молекулярную массу растворенного вещества, если раствор, содержащий 48 г растворенного вещества в литре, при 200С обладает осмотическим давлением 3,1 бар?
Решение
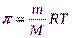 , отсюда
, отсюда 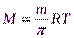 ;
;
m = 48 г = 4,8 ∙ 10-2 кг, R = 8,31 ∙ 103 Дж/кмоль∙град;
Т = 293К. π = 3,1 бар = 3,1 ∙ 1,013 ∙ 105 Н/м2;
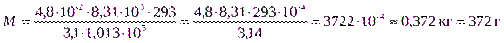
Ответ. Молекулярная масса растворенного вещества равна 372 а.е.м.
Задание для самостоятельного выполнения.
Вариант 1 (Артамонова, Анциферова, Устинова, Барыкин, Харченко)
Задание 1.При 18ºС осмотическое давление 5%-ного раствора тростникового сахара равно 0,56×105 н/м2. Каково будет осмотическое давление, если раствор разбавить в два раза, а температуру повысить на 13°?
Задание 2. В 100г этилового спирта растворено 39г бензола С6Н6, рассчитайте повышение температуры кипения этого раствора, если эбуллиоскопическая константа спирта равна 1,11 С.
Задание 3. Сколько граммов глицерина (С3Н8О3) надо растворить в 90 г воды при 300С, чтобы понизить давление пара на 266,5 Н/м2?
Вариант 2 (Бондарь, Сухаренко, Демидова, Дроздовская, Данилова)
Задание 1. Определить концентрацию сахара (С12(Н2О)11) в растворе, если раствор закипает при 100,50С. Эбуллиоскопическая постоянная воды = 0,52.
Задание 2.Сколько граммов этилового спирта (С2Н5ОН) нужно растворить в 200 см3 воды, чтобы осмотическое давление этого раствора при 170С было равно 4,56 ·105н/м2?
Задание 3. Вычислить давление пара 20% раствора глюкозы (С6Н12О6) при 250С. Давление паров воды при данной температуре равно 3167,7 Н/м2.
Вариант 3 (Глубоковский, Иванько, Киселев, Азеуш, Мартыненко)
Задание 1: В 800г. H2O растворили 10г.С3Н8О3. Найти Ткр полученного раствора.
Задание 2. Определите осмотическое давление раствора, содержащего 12г мочевины CО (NН2)2 в 2л раствора, при 20° С.
Задание 3.В 150 г водного раствора содержится 34,2 г сахара (С12Н22О11). Вычислить давление пара этого раствора при 300С, если давление паров воды – 4242 Н/м2.
Вариант 4 (Дудник, Ровкина, Копылов, Коровяковский)
Задание 1. Осмотическое давление раствора, содержащего 0,3680г мочевины в 200см3, при 20° С имеет значение 74630 Па. Определите молярную массу мочевины.
Задание 2. В 100г бензола растворено 2.56г нафталина С10Н8, рассчитайте понижение температуры замерзания этого раствора, если криоскопическая константа бензола равна 5,2.
Задание 3. Вычислить давление пара раствора 6,4 г нафталина (С10Н8) в 90 г бензола при 200С. Давление паров бензола равно 9953,8 Н/м2.