ОБЩАЯ ХИМИЯ ВСЕХ СПЕЦИАЛЬНОСТЕЙ 1 КУРСА 2 СЕМЕСТРА.
$$$ 1
В 1 литре раствора содержится 98 г H2SO4 (MH2SO4=98 г/моль). Какова молярная концентрация раствора?
Моль
$$$ 2
В 100 мл раствора содержится 3,4 г AgNO3 (MM=170 г/моль). Какова нормальность раствора? 0.2
$$$ 3
Определите эквивалентную концентрацию раствора HNO3, содержащего 6,3 г HNO3 в 100 мл раствора. 1нормальный
$$$ 4
80 г вещества-неэлектролита, имеющего молярную массу 80 г/моль растворено в 2 кг воды. KH2O=1,860. Определите температуру замерзания раствора. 0
$$$ 5
Вычислите рОН 0,01М раствора HNO3 . 10
$$$ 6
Вычислите рН 0,01М раствора КОН. 2
$$$ 7
Укажите соль, раствор которой имеет щелочную среду.
А)K2SO4
В)K2CO3
С)MgSO4
D)CuCl2
Е)NaNO3
$$$ 8
Если рОН раствора равно 3, то чему равна концентрация ионов водорода? 10-11
$$$ 9
Укажите соль, не подвергающуюся гидролизу.
А)KNO3
В)K2S
С)MgSO4
D)AlCl3
Е)Na2CO3
$$$ 10
В результате гидролиза какой соли образуется основная соль?
А)CsCl
В)Ba(NO3)2
С)FeCl3
D)K2S
Е)Na2CO3
$$$ 11
Определите титр 0,25Н раствора NaOH. 0.01
$$$ 12
Укажите слабый электролит.
А)HNO3
В)NaOH
С)Al(OH)3
D)Na2SO4
Е)KCl
$$$ 13
Раствор, содержащий 8 г некоторого вещества в 100 г диэтилового эфира, кипит при 36,860С тогда как чистый эфир кипит при 35,600С. Определить молекулярную массу растворенного вещества. 20.5
$$$ 14
При полной диссоциации Na3PO4 образуется ионов: 4
$$$ 15
В результате гидролиза какой соли образуется кислая соль?
А)KNO3
В)CuSO4
С)NiCl2
D)K2S
Е)Na2SO4
$$$ 16
Вычислите массовую долю (%) соли в растворе, содержащем 50 г соли и 200 г воды. 20
$$$ 17Растворимость BaSO4 2,3 *10-4.Определить ПР. 5.29*10-8
$$$ 18
Как окрасится лакмус в растворе карбоната калия?
А)фиолетовый
В)синий
С)красный
D)не окрасится
Е)желтый
$$$ 19
Смешиваются равные объемы 0,04М HCl и 0,03М NaOH. Вычислите рН полученного раствора. 7
$$$ 20
Какую массу NaNO3 нужно растворить в 400 г воды, чтобы приготовить 20 %-ный раствор? 100
$$$ 21
Укажите раствор какой соли при гидролизе имеет щелочную среду рН>7
А)CuSO4+HOH®
В)MgCl2+HOH®
С)KNO3+HOH®
D)CH3COONa+HOH®
Е)Na2SO4+HOH®
$$$ 22
В 100 мл раствора содержится 49 г H2SO4. Какова нормальность раствора? 10
$$$ 23
Гидролиз какой соли идет в три ступени?
А)CrCl3
В)(NH4)SO4
С)NaCN
D)K2S
Е)Zn(NO3)2
$$$ 24
Укажите раствор какой соли при гидролизе имеет кислую среду (рН<7).
А)Na2CO3
В)K2SO4
С)CuCl2
D)NaCl
Е)FeS
$$$ 25
Если рОН раствора равен 3, то чему равна концентрация ионов водорода? 10-11
$$$ 26
Определить температуру кипения раствора (0С), содержащего 3,46 г мочевины CO(NH2)2 в 100 г воды. Эбулиоскопическая константа воды равна 0,520. 55.5
$$$ 27
В 100 мл раствора содержится 3,4 AgNO3. M(AgNO3=170 г/моль). Какова нормальность раствора? 0.2
$$$ 28
Какой газ выделяется при совместном конечном гидролизе солей в реакции: AgCl3+Na2CO3+HOH®
А)Cl2
В)H2
С)CO
D)O2
Е)CO2
$$$ 29
В растворе какой соли рН будет наибольшим?
А)K2CO3
В)Al(NO3)3
С)FeCl3
D)Cu(CH3COO)2
Е)ZnSO4
$$$ 30
30 г неэлектролита растворено в 500 г воды. КН2О=1,860С. Раствор замерзает при –1,860С. Определите молярную массу растворенного вещества (г/моль). 19
$$$ 31
Укажите раствор какой соли при гидролизе имеет щелочную среду рН>7.
А)CuSO4+HOH®
В)MgCl2+HOH®
С)KNO3+HOH®
D)CH3COONa+HOH®
Е)Na2SO4+HOH®
$$$ 32
Азот объемом 11,2 л имеет массу: 14 г
$$$ 33
Каково математическое выражение ПР сульфата кальция?
А)ПРCaSO4=[Ca2+][SO42-]
В)ПРCaSO4=[Ca +2][SO -2]
С)ПР Caso4=[Ca+2][SO4 -2]2
Д)ПРCaSO4=[Ca+2]2[SO4-2]
Е)ПРCaSO4=[Ca+2]2[SO4-2]2
$$$ 34
Для какой из перечисленных солей гидролиз идет через образование основной соли?
А)ZnCl2
В)KCN
С)NaNO2
D)NH4Cl
Е)Li2S
$$$ 35
Концентрация гидроксид-ионов в растворе равна рОН=10-4. Определить рН раствора. 10-1
$$$ 36
Укажите рН раствора хлороводородной кислоты, если концентрация [Н+]=1*10-3 3
$$$ 37
Раствор массой 120 г содержит 24 г гидроксида калия (КОН). Какова массовая доля вещества в растворе (w, %)? 20 %
$$$ 38
В 160 г воды растворили 40 г соли. Чему равна массовая доля вещества в растворе? 20%
$$$ 39
Нормальная концентрация раствора, содержащего 10,5 г фтористого натрия MNaF=42 г/моль в 250 мл водного раствора равна: 1 нормальный
$$$ 40
Укажите сильный электролит.
А)H2CO3
В)H3PO4
С)Na NO3
D)Cu(OH)2
Е)H2S
$$$ 41
Из 400 г 50 %-ного (по массе) раствора H2SO4 выпариванием удалили 100 г воды. Чему равна массовая доля (%) H2SO4 в оставшемся растворе? 66.7
$$$ 42
Сколько граммов (г) Na2CO3 cодержится в 500 мл 0,25Н раствора? 6.6
$$$ 43
Концентрация ионов водорода в растворе равна 1*10-3 моль/л. Определить рН раствора. 3
$$$ 44
Определить ПРAg2C2O4, если растворимость Ag 2C 2 O 4 равна3,27*10-3. 5.7*10-12
$$$ 45
Рассчитать, при какой температуре (0С) должен кристаллизоваться раствор, содержащей в 250 г воды 54 г глюкозы C6H12O6. 0
$$$ 46
В 1 литре содержится 49 г H2SO4. Какова нормальность раствора. Mr(H2SO4)=98 г/моль. 1 нормальный
$$$ 47
Раствор массой 125 г содержит 25 г гидроксида натрия (NaOH). Какова массовая доля вещества в растворе (w, %)? 20%
$$$ 48
рН раствора равен 6, то чему равна концентрация ионов водорода в этом растворе? 10-6
$$$ 49
Если рОН раствора равен 5, то чему равна концентрация ионов водорода? 10-9
$$$ 50
В растворе какой соли рН будет наибольшим?
А)Al(NO3)3
В)FeCl3
С)Zn(CH3COO)2
D)Na2CO3
Е)MgSO4
$$$ 51
В растворе какого вещества ионов серебра больше (Ag+), если произведение растворимости (ПР) их соответственно равны:
А)AgBr 7,7*10-13
В)AgCl 1,7*10-10
С)Ag2CO3 5,7*10-12
D)AgCN 1,0*10-21
Е)Ag2S2O3 1,0*10-28
$$$ 52
Какую массу (г) поваренной соли (NaCl) надо взять для приготовления 120 г раствора с массовой долей 10%? 12г
$$$ 53
Чему равно осмотическое давление (мПа) 0,5М раствора глюкозы (С6Н12О6) при 250С?
$$$ 54
В 1 л раствора содержится 6,3 г HNO3 (М.м.=63 г/моль). Чему равна молярная концентрация раствора?. 0.1 м
$$$ 55
При растворении 5,0 г вещества в 200 г воды получается не проводящий тока раствор, кристаллизующийся при –1,450С. Определить молекулярную массу растворенного вещества (г/моль).
$$$ 56
Массовая доля (w, %) гидроксида натрия в 9,28Н растворе NaOH (r=1,310 г/мл) равна:
$$$ 57
Отношение количества растворенного вещества к массе растворителя называется:
А)нормальная концентрация
В)молярная концентрация
С)моляльная концентрация
D)мольная доля
Е)титр
$$$ 58
Отношение числа эквивалентов растворенного вещества к объему раствора называется:
А)массовая доля
В)нормальнаяконцентрация
С)мольная доля
D)титр
Е)моляльность
$$$ 59
Как надо изменить концентрацию ионов водорода в растворе, чтобы рН раствора увеличился на единицу?
А)увеличить в 10 раз
В)увеличить в 2 раза
С)увеличить на 1 моль/л
D)уменьшить в 10 раз
Е)уменьшить на 1 моль/л
$$$ 60
В растворе какого электролита можно обнаружить хлорид ион?
А)NaClO
В)NaCl
С)NaClO3
D)NaClO2
Е)NaClO4
$$$ 61
При диссоциации какого электролита получается гидроксокатион?
А)CuSO4
В)NaHCO3
С)Al(Ac)3
D)CuOHCl
Е)NaH2PO4
$$$ 62
При диссоциации какого электролита получается гидроанион?
А)AlOHCl2
В)Na2SO4
С)NH4OH
D)(CuOH)2SO4
Е) Na2HPO4
$$$ 63
На сколько градусов повысится температура кипения раствора сахара, если в 200 г Н2О растворить 40 г сахара С12Н22О11. (МС12H22O11=342 г/моль). ЕН2О=0,520. 5
$$$ 64
На сколько градусов понизится температура замерзания раствора глицерина, если в 100 г Н2О растворить 10 г глицерина С3Н8О3 (МС3Н8O3=92 г/моль). КН2О=1,860С. 7
$$$ 65
Укажите реакцию гидролиза.
А)CO2+H2O®
В)CaO+H2O®
С)Na+H2O®
D)Zn(NO3)+H2O®
Е)NaOH+H2SO4®
$$$ 66
Какая из солей не подвергается гидролизу?
А)K2CO3
В)NH4Cl
С)Na2SO4
D)(NH4)2S
Е)FeCl3
$$$ 67
Укажите раствор какой соли при гидролизе имеет щелочную реакцию среды, т.е. рН>7.
А)NaCN
В)NH4Cl
С)FeCl3
D)NH4CH3COO
Е)CuBr2
$$$ 68
Укажите раствор какой соли при гидролизе имеет нейтральную реакцию среды, т.е. рН=7?
А)NaHCO3
В)NH4CN
С)Cu(NO3)2
D)K2S
Е)AlCl3
$$$ 69
Укажите вещество электролит.
А)Cu
В)CuO
С)O2
D)CuSO4
Е)NO
$$$ 70
Укажите вещество неэлектролит.
А)ZnCl2
В)Na2SO4
С)CrCl3
D)MnO
Е)Cu(NO3)2
$$$ 71
Какая из указанных кислот в равных условиях, дает наименьшую концентрацию ионов водорода Н+.
А)HClO2 Kд=1*10-2
В)HClO Kд=2,95*10-8
С)HClO3 Kд=1*10+3
D)HClO4 Kд=1*10+8
Е)HCl Kд=1*10+8,9
$$$ 72
Укажите сильный электролит.
А)HNO3 a=94 %
В)СН 3СОOH a= 2 %
С)НNC a=0,15 %
D)NH4OH a=1,35 %
Е)H2CO3 a=0,17 %
$$$ 73
Какой электролит диссоциирует ступенчато?
А)KCN
В)H2SO4
С)NaOH
D)KNO3
Е)HCl
$$$ 74
В растворе какого электролита можно обнаружить хлорид-ионы Cl-?
А)NaClO
В)NaCl
С)NaClO3
D)NaClO4
Е)NaClO2
$$$ 75
Определите массовую долю (в процентах) гидроксида кальция w, % Ca(OH)2, если в 100 г раствора находится 5 г. 5%
$$$ 76
Укажите молярную концентрацию серной кислоты СМ(H2SO4), если в 1 л раствора находится 9,8 г серной кислоты. 0.2
$$$ 77
Чему равно рН раствора, если концентрация ионов водорода СН+=1*10-3 (рН=-lgCH+). 3
$$$ 78
Укажите рН раствора щелочи NaOH, если С(ОН-)=10-5 моль/л. 5
$$$ 79
Какое из оснований в ионно-молекулярных уравнениях записывается в виде молекулы?
А)NH4OH
В)NaOH
С)KOH
D)LiOH
Е)Ca(OH)2
$$$ 80
Какая из кислот в ионно-молекулярных уравнениях записывается в виде молекулы?
А)HNO3
В)H2SO4
С)H2S
D)HCl
Е)HClO4
$$$ 81
Какая реакция идет с образованием нерастворимого соединения?
А)Ni(OH)2+HNO3®
В)CaCO3+HCl®
С)Zn(OH)2+NaOH®
D)FeCl3+NaOH®
Е)H2SO4+KOH®
$$$ 82
Какая реакция имеет краткое ионное уравнение Н++ОН-=Н2О?
А)CH3COOH+Ca(OH)2®
В)H2CO3+KOH®
С)HNO3+NaOH®
D)H2SO4+Cu(OH)2®
Е)HCl+NH4OH®
$$$ 83
Какая реакция идет с образованием газообразного вещества?
А)CaCO3+HCl®
В)Na2SiO3+HCl®
С)Na2SO4+BaCl2®
D)NH4Cl+AgNO3®
Е)H2CO3+Ca(OH)2®
$$$ 84
В растворе какого вещества ионов серебра (Ag) больше, если произведение растворимости ПР их соответственно равны:
А)AgBr 7,7*10-13
В)AgCl 1,7*10-10
С)Ag2CO3 5,7*10-12
D)AgCN 1,0*10-21
Е)Ag2S2O3 1,0*10-28
$$$ 85
Укажите реакцию гидролиза соли.
А)MgO+H2O®
В)SO2+H2O®
С)Zn(NO3)2+H2O®
D)BaCO3+HCl®
Е)NaOH+H2SO4®
$$$ 86
Какая из солей не подвергается гидролизу?
А)NaCN
В)K2CO3
С)NH4Cl
Д)(NH4)2SO4
Е)KCl
$$$ 87
Щелочная среда pH>7 получается при растворении в воде соли:
А)Na2CO3
В)Zn(NO3)2
С)NH4Cl
D)K2SO4
Е)AlF3
$$$ 88
Укажите раствор какой соли при гидролизе имеет кислую среду (рН<7).
А)ZnS
В)MgCl2
С)Na2S
D)CH3COOH
Е)KCN
$$$ 89
Какое вещество проявляет только окислительные свойства?
А)MnO
В)MnO2
С)K2MnO4
D)KMnO4
Е)MnCl2
$$$ 90
Какое вещество проявляет только восстановительные свойства?
А)S
В)H2SO3
С)H2S
D)H2SO4
Е)Na2SO3
$$$ 91
Укажите соединение, содержащий ион в степени окисления “+4”.
А)Zn(OH)2
В)HClO3
С)KNO2
D)Na2SO3
Е)PbS
$$$ 92
Среди приведенных, укажите процесс окисления.
А)NO2-®NO3-1
В)SO42-®SO32-
С)Cl2®2Cl-
D)MnO4-® MnO2
Е)Cu2+®Cu0
$$$ 93
Среди приведенных, укажите процесс восстановления.
А)SO32-® SO42-
В)S2-®S0
С)MnO4-®MnO2
D)NH3®NO3-
Е)Cr0®Cr3+
$$$ 94
Чему равен эквивалент восстановителя в реакции:
K2Cr2O7+SnCl2+H2SO4®Sn(SO4)2+CrCl3+K2SO4 (MK2Cr2O7=294 г/моль; MSnCl2=190 г/моль). 190/2
$$$ 95
Низшая и высшая степень окисления азота равна: -3 +5
$$$ 96
Число моль Н+, участвующих в восстановлении иона ClO3- в ион Cl- равно: 6 ионов 3моль
$$$ 97
Чему равен эквивалент окислителя в реакции:
HNO3+H2S®NO+S+H2О MHNO3=63 г/моль; MH2S=34 г/моль 63/3
$$$ 98
Укажите соединение, в котором степень окисления центрального иона равна “+6”.
А)HNO3
В)KMnO4
С)K2Cr2O7
D)H2S
Е)H2O2
$$$ 99
К какому типу реакции относится: Na2O2+CO2®Na2CO3+O2
А)межмолекулярный
В) внутримолекулярный
С)не является окислительно – восстановительной
D)диспропорционирования
Е)реакция замещения
$$$ 100
Укажите окислитель:
А)KMnO4
В)H2S
С)Mn
D)H2SO3
Е)O22-
$$$ 101
Закончите уравнение реакции. Укажите коэффициент перед восстановителем: Mg+HNO3®Mg(NO3)2+NH4NO3+H2O 4
Е)12
$$$ 102
Укажите процесс окисления.
А)H3AsO3®H3AsO4
В)As2O5®As2O3
С)As2O3®AsH3
D)H3AsO4®As2O5
Е)As2O3®HАsO2
$$$ 103
Укажите процесс восстановления.
А) MnO4-®MnO2
В)2O-2®O2
С)Fe®Fe+3
D)2Br-®Br20
Е)NO2-®NO3-
$$$ 104
Укажите процесс окисления.
А)Na3PO4®H3PO4
В)H3PO4®AlPO4
С)P2O3®H3PO4
D)H3PO4®P2O5
Е)H3PO4®HPO3
$$$ 105
Определите в ОВР число молей окислителя:
KMnO4+H2S+H2SO4®MnSO4+K2SO4+S¯+H2O 2
$$$ 106
Определите число электронов, участвующих в данной ОВР:
KMnO4+NaNO2+H2SO4®MnSO4+NaNO3+K2SO4+H2O 10
$$$ 107
Определите число молей окислителя в следующей ОВР:
KMnO4+NaNO2+КОН®К2MnO4+NaNO3+H2O 2
$$$ 108
Определите число молей окислителя в следующей ОВР:
NaBr+NaBrO3+H2SO4®Br2+Na2SO4+H2O 1
$$$ 109
Определите число молей восстановителя в следующей ОВР.
NaCrO2+PbO2+NaOH®Na2PbO2+Na2CrO4+H2O 3
$$$ 110
Какое соединение хлора проявляет только окислительные свойства?
А)KCl
В)NaClO
С)HClO4
D)Ca(ClO3)2
Е)KClO2
$$$ 111
Какое соединение серы проявляет только восстановительные свойства?
А)H2S
В)Na2SO3
С)H2SO4
D)SO2
Е)Na2S2O3
$$$ 112
Укажите вещество с нулевой степенью окисления атома.
А)PH3
В)Al
С)KOH
D)HClO
Е)NO2
$$$ 113
Чему равна степень окисления галогенов F2, Cl2, I2, Br2 в свободном состоянии? 0
$$$ 114
Укажите соединение, в котором кислород имеет положительную степень окисления +2.
А)Al2O3
В)H2O
С)KNO3
D)OF2
Е)Cu(OH)2
$$$ 115
Укажите соединение со степенью окисления хлора +1.
А)HCl
В)HClO
С)HClO2
D)Cl2O5
Е)Cl2О7
$$$ 116
Укажите элемент с постоянной степенью окисления.
А)K
В)Mn
С)Cl
D)N
Е)S
$$$ 117
В каком из приведенных соединений азот проявляет только окислительные свойства?
А)NH3
В)N2
С)N2O
D)NO2
Е )HNO3
$$$ 118
Какое соединение серы проявляет одновременно и окислительные и восстановительные свойства?
А)H2S
В)Na2S
С)K2SO3
D)SO3
Е)H2SO4
$$$ 119
В каком из следующих превращений произошла отдача пяти электронов?
А)Al0®Al+3
В)Mn+2®Mn+7
С)Cl-1®Cl+
D)Ca+2®Ca0
Е)V+5®V+3
$$$ 120
В каком из следующих превращений произошло присоединение двух электронов?
А)N  O®2N-3
O®2N-3
В)N+5®N+3
С)N20®2N-3
D)N+1®N+2
Е)N+2®N-3
$$$ 121
Укажите окислительно-восстановительную реакцию.
А)Zn+S®ZnS
В)CaO+H2O®Ca(OH)2
С)BaO+CO2=BaCO3
D)NaCl+AgNO3=AgCl¯+NaNO3
Е)CuSO4+2NaOH=Cu(OH)2+Na2SO4
$$$ 122
Укажите процесс восстановления (принятие электронов).
А)Сl+1®Cl-1
В)Cl+3®Cl+7
С)Cl+5®Cl+7
D)2Cl-®Cl02
Е)Cl+5®Cl+7
$$$ 123
Уравняйте реакцию Са+Н2О®Са(ОН)2+Н2. В ответе укажите число молей окислителя. 2
$$$ 124
Уравняйте реакцию H2S+H2SO3®H2O+S. В ответе укажите число молей восстановителя. 2
$$$ 125
Пластинка из какого металла быстрее растворится в растворе CuSO4?
А)Sn
В)Co
С)Ni
D)Fe
Е)Pb
$$$ 126
Рассчитайте стандартную ЭДС (В) цинково-серебряного гальванического элемента. Е0Zn2+/Zn=-0,76B. E0Ag+/Ag=+0,80B 1,56.
$$$ 127
При взаимодействии с каким из растворов солей масса свинцовой пластинки уменьшится?
А)MnSO4
В)CuSO4
С)ZnSO4
D)FeCl2
Е)CdSO4
$$$ 128
Укажите вещество, которое будет выделяться на аноде при электролизе соли Mg(NO3)2.
А)Mg
В)H2
С)O2
D)NO
Е)NO2 $$$ 129
Стандартный потенциал какого электрода принят равным 0?
А)медного
В)водородного
С)кислорода
D)каломельного
Е)золотого
$$$ 130
Определите электродный потенциал (В) цинка в 0,01М растворе соли ZnSO4. E0Zn2+/zn=-0,76B.
$$$ 131
Какие вещества будут выделяться на электродах при электролизе смеси растворов AuCl3 и KCl?
А) K и Au
В)K и Cl2
С)Au и O2
D)Au и Cl2
Е)H2 и Cl2
$$$ 132
Электродвижущая сила (В) гальванического элемента Zn0/Zn2+//Mg2+/Mg равна, где E0Zn/Zn2+=-0,76B; E0Mg/Mg2+=-2,37B +1,51.
$$$ 133
По закону Фарадея, масса веществ при электролизе определяется по формуле:
А)m=I*t
В) 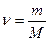
С) 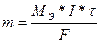 D)m=r*V
D)m=r*V
Е) 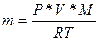
$$$ 134
Определите силу тока, при которой на катоде выделилось 0,5 г Au в течение 30 минут из раствора AuCl3. 1,15 а
$$$ 135
Какое вещество содержится в растворе у анода по окончании электролиза раствора AgNO3?
А)Ag
В)HNO3 С)Ag2O
D)O2
Е)NO2
$$$ 136
Определите электродный потенциал (В) меди в 0,01М растворе соли CuSO4: E0Cu2+/Cu=+0.34B.
$$$ 137
Какой из катионов металлов будет первым восстанавливаться на катоде при совместном присутствии?
А)Na+
В)Mg2+
С)Zn2+
D)Cd2+
Е)Cu2+
$$$ 138
Какое количество железа выделится на катоде, если через раствор FeCl3 пропустить в течение 2 минут ток силой 1,5 А? 2
$$$ 139
Укажите возможную реакцию.
А)Сu+HCl®
В)Ag+H2O®
С)Au+K2SO4®
D)Cu+AgNO3®
Е)Al+BaCl2®
$$$ 140
Какая реакция замещения будет протекать?
А)Mg+KCl®
В)Fe+K2SO4®
С)Cu+AuCl3® D)Ag+ZnCl2®
Е)Sn+Al(NO3)3®
$$$ 141
Значение электродных потенциалов в гальваническом элементе соответственно равны: jок-ля=+0,54 В, jв-ля= -0,73 В. Рассчитать ЭДС системы 1,27.
$$$ 142
Какой из указанных металлов вытесняет водород из воды?
А)Cu
В)Ca
С)Ag
D)Au
Е)Pt
$$$ 143
Пластинка цинка, опущенная в раствор дихлорида олова (SnCl2), уменьшилась на 0,2 г. Сколько грамм олова выделилось? АSn=118 г/моль, АZn=65,4 г/моль. 155
$$$ 144
На железной пластинке, опущенной в раствор сульфата меди, выделилось 1,5 г меди. На сколько грамм растворилась железная пластинка? АFe=55,84 г/моль, АCu=63,54 г/моль. 160
$$$ 145
Укажите схему гальванического элемента, в котором никелевая пластинка служит анодом.
А)Ca/Ca2+//Ni2+/Ni0
В)Al/Al3+//Ni2+/Ni0
С)Ni0/Ni2+//Pb2+/Pb0
D)Fe0/Fe2+//Ni2+/Ni0
Е)Mg0/Mg2+//Ni2+/Ni0
$$$ 146
Укажите в каком случае ЭДС гальванического элемента будет наименьшей?
А) Mg0/Mg2+//Zn2+/Zn0 E0Mg/Mg2+=-2,34 B E0Zn/Zn2+=-0,76 B
В) Mg0/Mg2+//Al3+/Al0 E0Al/Al3+=+1,67 B
С) Mg0/Mg2+//Mn2+/Mn0 E0Mn/Mn2+=-1,05 B
Д) Mg0/Mg2+//Fe2+/Fe0 E0Fe/Fe2+=-0,44 B
Е) Mg0/Mg2+//Co2+/Co0 E0Co/Co2+=-0,28 B
$$$ 147
Какой металл первым будет восстанавливаться при электролизе водных растворов солей?
А) Fe0 / Fe2+ Е0= -0,44 В
В) Zn0/ Zn2+ Е0= -0,76 В
С)Сr / Cr3+ Е0= -0,71 В
D)Pd2+/Pd0 Е0= +0,83 В
Е)Au3+/Au0 Е0= +1.42 В
$$$ 148
При электролизе раствора какой соли будет выделяться на аноде О02.
А)CuCl2
В)NaI
С)K2SO4 D)KCl
Е)NaBr
$$$ 149
Ток силой 2,5 А, проходя через раствор электролита, за 30 минут выделяет из раствора 2,77 г металла. Найти эквивалентную массу металла. 3
$$$ 150.
Укажите тип кристаллической решетки вещества и вид связи, образованные элементами с сокращенными электронными конфигурациями атомов …3s1 и 3s23p5:
A) атомная, ковалентная неполярная;
В) молекулярная, ковалентная полярная;
С) молекулярная, ковалентная неполярная;
Д) металлическая решетка, металлическая связь;
Е) ионная решетка, ионная связь.
$$$ 151
Какие вещества выделятся на катоде и аноде при электролизе водного раствора сульфата натрия?
А)Na, O2
В)H2, SO2
С)Na, SO3
D)H2, O2
Е)Na, SO3
$$$ 152
Какой металл не подвергается коррозии?
А)Na
В)Fe
С)Mg
D)Mn
Е )Au
$$$153
Определить электродвижущую силу (ЭДС) гальванического элемента состоящего из свинцовой и магниевой пластинок, опущенных в растворы соответственных солей, если [Pb2+]=[Mg2+]=0,01 моль/л. E0Mg2+/Mg=-2,36 B; E0Pb2+/Pb=-0,13 B.
$$$ 154
Определить ЭДС гальванического элемента состоящего из магниевой и медной пластинок, опущенных в растворы соответственных солей, если [Mg2+]=[Cu2+]=0,01 моль/л. E0Mg2+/Mg=-2,34 B; E0Cu2+/Cu=+0,34 B.
$$$ 155
Определить ЭДС гальванического элемента Zn/Zn2+(0,01 моль/л)//Cd2+(0,01 моль/л)/Cd, ес;0Cd2+/Cd=-0,43 B; E0Zn2+/Zn=-0,76 B.
$$$ 156
Определить ЭДС гальванического элемента Zn/Zn2+ (0,01 моль/л)//Ag+ (0,01 моль/л)/Ag, если E0Zn2+/Zn=-0,76 В; E0Ag+/Ag=+0,80 B.
$$$ 157
В каком гальваническом элементе на катоде восстанавливается водород при стандартных условиях?
А)Zn/Zn2+//Pb2+/Pb
В)Zn/Zn2+//Cu2+/Cu
С)Zn/HCl/Cu
D)Zn/Zn2+/Ag+/Ag
Е)Zn/Zn2+//Ni2+/Ni
$$$ 158
При электролизе раствора CuSO4 на электродах (катоде и аноде) выделяются вещества:
А)Cu и SO2
В)Cu и O2
С)H2 и SO2
D)H2 и O2
Е)Cu и H2
$$$ 159
При электролизе раствора Cu(NO3)2 на электродах (катоде и аноде) выделяются вещества:
А) H2 и NO2
В)Cu и O2
С) Cu и NO2
D) H2 и O2
Е) H2 и Cu
$$$ 160
При электролизе раствора NaNO3 на катоде и аноде выделяются вещества:
А) Na и O2
В) Na и NO2
С) H2 и NO2
D) H2 и O2
Е) NO2 и O2
$$$ 161
При электролизе водного раствора какой соли на катоде выделяется только металл?
А)SnCl2
В)KCl
С)Hg(NO3)2
D)Ba(CH3COO)2
Е)FeSO4
$$$ 162
Определите массу цинка, выделившегося на катоде при электролизе раствора сульфата цинка в течение 1 часа при токе 26,8 А, если выход цинка по току равен 50 %.
$$$ 163
Катализаторы – вещества, которые:
А) увеличивают скорость химической реакции, участвуя в ней, но не расходуясь;
В) смещают химическое равновесие;
С) уменьшают скорость химической реакции;
Д) увеличивают скорость химической реакции, участвуют в ней и расходуются.
Е) не влияют на скорость химической реакции.
$$$ 164
В строении атома алюминия и кремния одинаковое:
А) высшая валентность;
В) заряд ядра;
С) количество энергетических уровней;
Д) номер группа;
Е) количество электронов на внешнем энергетическом уровне.
$$$ 165
Какой силы ток должен быть использован для того, чтобы выделить из раствора AgNO3 серебро массой 108 г за 6 мин. 0,3
$$$ 166
Определить выход по току кадмия, если при электролизе в течение 1 часа на катоде выделился кадмий массой 5,62 г, а ток был равен 5,36 А. 5
$$$ 167
Какой из металлов не растворяется в серной кислоте?
А)Cr
В)Al
С)Fe
D)Zn
Е)Au $$$168
В каких единицах изменяется ЭДС (Е) гальванического элемента?
А)кулонах
В)градусах Кельвина
С)калориях
D)вольтах Е)амперах
$$$ 169
Какой из металлов может вытеснить водород из воды?
А)калий В)медь
С)серебро
D)золото
Е)платина
$$$ 170
Какая реакция замещения будет протекать?
А)Zn+AlCl3®
В)Ni+Cu(NO3)2®
С)Ag+Pb(NO3)2®
D)Fe+ZnCl2®
Е)Cu+MgCl2®
$$$ 171
В какой паре металлов (условия стандартные) никель будет анодом в гальваническом элементе?
А)Ni и Fe
В)Ni и Zn
С)Ni и Cu
D)Ni и Al
Е)Ni и Cr
$$$ 172
У какого элемента металлические свойства выражены сильнее?
А)Na j0=-2,71 B
В)Al j0=-1,67 B
С)Zn j0=-0,76 B
Д)Sn j0=-0,14 B
Е)Cu j0=+0,34 B
$$$ 173
Какие вещества выделяются на катоде при электролизе водного раствора хлорида калия?
А)K, O2
В)H2, Cl2
С)H2, O2
D)K, Cl2
Е)K, H2
$$$ 174
В результате окисления ОН--гидроксид-ионов, какой газ выделяется на аноде?
А)О2
В)Н2
С)О2-
D)ОН-
Е)Н2О
$$$ 175
У какого из металлов образуется на поверхности плотная оксидная защитная пленка?
А)K
В)Ca
С)Al
D)Fe
Е)Na
$$$ 176
Чему равна ЭДС гальванического элемента, составленного из полуэлемента Zn/Zn+2 j0=-0,76 B и водородного электрода j0=0,00 В (условия стандартные)? 0,76
$$$ 177
Какие процессы протекают на катоде при электролизе расплава NaCl. В ответе укажите массу (г) на катоде при электролизе расплава, если условия электролиза следующие: I=10 A, t=1час, F=96500 кл.
$$$ 178
Распознать катионы бария в водном растворе можно с помощью
А) сульфат –ионов;
В) хлорид – ионов;
С) нитрат – ионов;
Д) гидроксид;
Е) катионов водорода.
$$$ 179
Определить ЭДС гальванического элемента (В)
Ag/AgNO3 (0,001M)//AgNO3 (0,1M)/Ag, если E0Ag/Ag+=+0,80В 0.67
$$$ 180
Ток силой 2,5 А, проходя через раствор электролита, за 30 мин выделяет из раствора 2,77 г металла. Найти эквивалентную массу металла. 2
$$$ 181
В кристаллическом состоянии атомы металлов связаны
А) металлической связью;
В) водородной связью;
С) ионной связью;
Д) ковалентной связью;
Е) донорно-акцепторной связью.
$$$ 182
Укажите соль, раствор которой имеет кислую среду (рН<7).
А)K2S
В)Na2SO4
С)MgCl2
D)Na2CO3
Е)KCl
$$$ 183
Укажите соль, раствор которой имеет щелочную среду (рН>7).
А)NaCl
В)Na2S
\ С)ZnSO4
D)FeCl3
Е)BaCl2
$$$ 184
Какая из указанных солей не подвергается гидролизу?
А)K2CO3
В)NiSO4
С)AlCl3
D)LiCl
Е)Fe(NO3)3
$$$ 185
Гидролиз какой соли идет в три ступени?
А)NiCl2
В )AlCl3
С)KCN
D)Na2S
Е)Mg(NO3)2
$$$ 186
Какой из катионов металлов будет первым восстанавливаться на катоде при совместном присутствии?
А)K+
В)Mg2+
С)Zn2+
D)Cu2+
Е)Cd2+
$$$ 187
В гальваническом элементе самое высокое значение ЭДС (условия стандартные):
А)Zn0/Zn2+//Pb2+/Pb0
В)Zn0/Zn2+//Ag+/Ag0
С)Zn0/Zn2+//Ca2+/Ca0
D)Zn0/Zn2+//Ni2+/Ni0
Е)Zn0/Zn2+//Cu2+/Cu0
$$$ 188
При электролизе раствора MgCl2, на катоде выделяется:
А)Mg
В)Cl
С)H
D)O2
Е )H2
$$$ 189
При электролизе раствора CuCl2 на катоде выделяется:
А)Cu
В)Н2
С)О2
D)Н
Е)Н2О
$$$ 190
Щелочная среда получается при растворении в воде соли:
А)NaCl
В)KNO3
С)K2SO4
D)K2S
Е)Al(NO3)3
$$$ 191
В каком ряду записаны только амфотерные гидроксиды?
А)Mn(OH)2, Cu(OH)2, Mg(OH)2
В)Be(OH)2, Zn(OH)2, Cr(OH) 3
С)Co(OH)3, Fe(OH)3, Al(OH)3
D)KOH, NH4OH, LiOH
Е)NaOH, AgOH, AuOH
$$$ 192
Какое уравнение соответствует образованию основной соли?
А)KOH+H2SO4®
В)Zn(OH)2+HNO3®
С)NH4OH+H2S®
D)NaOH+HCN®
Е)LiOH+H3PO4®
$$$ 193
Какое уравнение соответствует образованию кислой соли
А)KOH+HNO3®
В)HCl+Fe(OH)3®
С)NaOH+H2SO3®
D)Cr(OH)3+CH3COOH®
Е)Ca(OH)2+HCl®
$$$ 194
Какая из перечисленных солей основная?
А)NaHS
В)BaSO4
С)KCl
D)NaNO3
Е)FeOHCl2
$$$ 195
Укажите вещество, взаимодействующее с NaOH с образованием воды
А)K2SO4
В)KOH
С)Ba(OH)2
D)KNO3
Е)HCl
$$$ 196
Какое уравнение соответствует образованию основной соли?
А)Al(OH)3+HCl®
В)NaOH+HCN®
С)KOH+HNO3®
D)NH4OH+H2SO4 ®
Е)KOH+H2S®
$$$ 197
Укажите вещество, с которым будет взаимодействовать гидроксид натрия:
А)K2O
В)CaO
С)SO3
D)BaO
Е) Fe2O3
$$$ 198
Какое уравнение соответствует образованию основной соли?
А)HCl+NH4OH®
В)CuSO4+KOH®
С)AlCl3+NaOH®
D)AgNO3+NaCl®
Е)Na2CO3+HNO3®
$$$ 199
Укажите реакцию образования гидроксида бериллия:
А)BeCl2+AgNO3®
В)BeO+H2SO4®
С)BeSO4+BaCl2®
Д)Be(NO3)2+Ca(OH)2®
Е)BeCO3+HCl®
$$$ 200
Укажите формулу хлорной кислоты:
А)HCl
В)HClO
С)HClO2
D)HClO3
Е)HClO4
$$$ 201
Какая из перечисленных солей кислая?
А)K2SO4
В)BaCl2
С )NaHCO3
D)Al(SO4)3
Е)MgOHCl
$$$ 202
В каком ряду увеличивается основной характер оксидов:
А)CaO®SrO®BaO
В)CaO®CrO®CuO
С)As2O3®BiO3®Sb2O3
D)Cs2O®BaO®CdO
Е)MnO®MnO3®Mn2O7
$$$ 203
Какое уравнение соответствует образованию кислой соли?
А)Al(OH)3+HNO3®
В)NaOH+H2S®
С)NaOH+HCl®
D)KOH+HNO3®
Е)NaOH+HCN®
$$$ 204
Укажите вещество, с которым будет реагировать гидроксид калия.
А)CaO
В)SO3
С)Mg(OH)2
D)BaO
Е)Fe(OH)3
$$$ 205
В каком ряду записаны только амфотерные гидроксиды?
А)Mn(OH)2, Cu(OH)2, Al(OH)3
В)Co(OH)3, Fe(OH)3, Cr(OH)3
С)NaOH, NH4OH, KOH
D)Be(OH)2, Zn(OH)2, Al(OH)
Поделиться:
Поиск по сайту
Все права принадлежать их авторам. Данный сайт не претендует на авторства, а предоставляет бесплатное использование.
Дата создания страницы: 2016-04-26
Нарушение авторских прав и Нарушение персональных данных