ОСНОВНЫЕ КЛАССЫНЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Степень окисления – это условный электрический заряд данного атома, вызванный смещением валентных электронов к более электроотрицательному атому. Валентными электронами называются электроны, участвующие в образовании химической связи (их число равно номеру группы, в которой стоит элемент). Ст. окис. может иметь отрицательное, положительное и нулевое значение, которое обычно выражают арабскими цифрами со знаком (+) или (-) и ставят над символом элемента.
Например:  ;
; 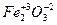 ;
;  ;
; 
Наиболее электроотрицательные элементы в соединении имеют отрицательные степени окисления, а атомы элементов с меньшей электроотрицательностью – положительные. Степень окисления - формальное понятие; в ряде случаев степень окисления не совпадает с валентностью.
Например:
 N2 H4 (гидразин)
N2 H4 (гидразин)
степень окисления азота – «-2»; валентность азота – III.
Валентность – это число связей, которые может образовать атом в соединениях.
Для вычисления степени окисления элемента учитывают следующие положения:
1. Степени окисления атомов в простых веществах равны нулю (Na0; H20).
2. Алгебраическая сумма степеней окисления всех атомов, входящих в состав молекулы, всегда равна нулю ([ S+6O3-2 ] 0), а в сложном ионе эта сумма равна заряду иона ([S+6O4-2]2-).
3. Постоянную степень окисления имеют атомы:
- щелочных металлов (+1),
- щелочноземельных металлов (+2),
- водорода (+1) (кроме гидридов активных металлов:  ,
,  и др.),
и др.),
- кислорода (-2) (кроме фторида кислорода O+2F2-1 и пероксидов, содержащих группу –O–O–, Н2О2-1).
4. Высшая положительная степень окисления элемента равна номеру группы ПС.
5. Низшая степень окисления вычисляется по формуле –(8 – N), где N – номер группы.
‼ Отрицательная степень окисления проявляется у неметаллов, начиная с IV группы.
ОКСИДЫ
Оксиды - это сложные хим. соединения, состоящие из двух элементов, один из которых кислород.
Классификация
| Несолеобразующие | - CO, N2O, NO |
| Солеобразующие: | Основные- это оксиды металлов, в которых последние проявляют небольшую степень окисления +1,+2 Na2O; MgO; CuO |
| Амфотерные - это оксиды металлов со степенью окисления +3, +4 ZnO; Al2O3; Cr2O3; SnO2 | |
| Кислотные- это оксиды неметаллов и металлов (со ст.ок. от +5 до +7) SO2; SO3; P2O5; Mn2O7; CrO3 |
Основным оксидам соответствуют основания;
Кислотным – кислоты;
Амфотерным – амфотерные гидроксиды, обладающие свойствами и кислот и оснований.
Номенклатура
Согласно современной международной номенклатуре любой оксид называется оксидом с указанием римскими цифрами степени окисления элемента, например: SО2 - оксид серы (IV) (читается: «оксид серы четыре»), SO3 - оксид серы (VI), CrO - оксид хрома (II), Сr2О3 - оксид хрома (III), СrО3 - оксид хрома (VI).
Получение
1. Взаимодействие простых и сложных веществ с кислородом:
2Mg + O2 ® 2MgO
2CO + O2 ® 2CO2
CH4 + 2O2 ® CO2 + 2H2O
2. Разложение некоторых кислородсодержащих веществ (оснований, кислот, солей) при нагревании:
Cu(OH)2  CuO + H2O
CuO + H2O
(CuOH)2CO3  2CuO + CO2 + H2O
2CuO + CO2 + H2O
2Pb(NO3)2  2PbO + 4NO2 + O2
2PbO + 4NO2 + O2
2HMnO4  Mn2O7 + H2O
Mn2O7 + H2O
Химические свойства
| Основные оксиды | Кислотные оксиды |
| 1. Взаимодействие с водой | |
| Образуется основание: Na2O + H2O ® 2NaOH (оксиды активных металлов) | Образуется кислота: SO3 + H2O ® H2SO4 (кроме SiO2) |
| С водой амфотерные оксиды не взаимодействуют | |
| 2. Взаимодействие с кислотой или основанием: | |
При реакции с кислотой ® соль и вода
MgO + H2SO4  MgSO4 + H2O MgSO4 + H2O
| При реакции с основанием ® соль и вода CO2 + Ba(OH)2 ® BaCO3 + H2O |
| 3. Взаимодействие основных и кислотных оксидов между собой приводит к образованию солей: | |
| Na2O + CO2 ® Na2CO3 | |
| 4. Восстановление до простых веществ: | |
| P2O5 + 5C ® 2P + 5CO | |
| Амфотерные оксиды взаимодействуют | |
| с кислотами как основные: ZnO + H2SO4 ® ZnSO4 + H2O | с основаниями как кислотные:
ZnO+ 2NaOH  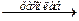 Na2ZnO2 + H2O
ZnO + 2NaOH + H2O ® Na2[Zn(OH)4] Na2ZnO2 + H2O
ZnO + 2NaOH + H2O ® Na2[Zn(OH)4]
|
| с кислотными оксидами как основные: ZnO + SO3 ® ZnSO4 | с основными оксидами как кислотные: ZnO+ Na2O → Na2ZnO2 |
ОСНОВАНИЯ
Основания - сложные хим. соединения, в которых атомы металлов соединены с одной или несколькими гидроксильными группами (с точки зрения теории электролитической диссоциации, основания - сложные вещества, при диссоциации которых в водном растворе образуются катионы металла (или NH4+) и гидроксид – анионы ОН-).
Классификация.
Основания бывают:
растворимые в воде (щёлочи) и нерастворимые (см. табл. растворимости).
по количеству ОН-групп:
однокислотные (NaOH) и многокислотные (Ba(OH)2, Fe(OH)3)
Номенклатура.
Согласно международной номенклатуре названия оснований составляются из слова гидроксид и названия металла. Например, NаОН - гидроксид натрия, КОН - гидроксид калия, Са(ОН)2 - гидроксид кальция. Если элемент образует несколько оснований, то в названиях указывается степень его окисления римской цифрой в скобках: Fe(ОН) 2 - гидроксид железа (II), Fe(ОН)3 - гидроксид железа (III).
Помимо этих названий, для некоторых наиболее важных оснований применяются и другие (технические, тривиальные). Например, гидроксид натрия NaОН называют едкий натр; гидроксид калия КОН - едкое кали; гидроксид кальция Са(ОН)2 - гашеная известь; гидроксид бария Ва(ОН)2 - едкий барит.
Получение
1. Реакции активных металлов (щелочных и щелочноземельных) с водой:
2Na + 2H2O ® 2NaOH + H2
2. Взаимодействие оксидов активных металлов с водой:
BaO + H2O ® Ba(OH)2
3. Электролиз водных растворов солей:
2NaCl + 2H2O  2NaOH + H2 + Cl2
2NaOH + H2 + Cl2
4. Нерастворимые в воде основания можно получить реакцией ионного обмена:
NiCl2 + 2NaOH ® Ni(OH)2↓ + 2NaCl
Химические свойства
| Щёлочи | Нерастворимые основания |
| 1. Действие на индикаторы. | |
| лакмус - синий фенолфталеин - малиновый | –– |
| 2. Взаимодействие с кислотными оксидами. | |
| 2KOH + CO2 ® K2CO3 + H2O KOH + CO2 ® KHCO3 | –– |
| 3. Взаимодействие с кислотами (реакция нейтрализации) | |
| NaOH + HNO3 ® NaNO3 + H2O | Cu(OH)2 + 2HCl ® CuCl2 + 2H2O |
| 4. Обменная реакция с солями | |
| Ba(OH)2 + K2SO4 ® 2KOH + BaSO4¯ 3KOH+Fe(NO3)3 ® Fe(OH)3¯ + 3KNO3 | –– |
| 5. Термический распад. | |
| –– | Cu(OH)2  CuO + H2O CuO + H2O
|
| 6. Амфотерные основания взаимодействуют | |
| – с кислотами, проявляя свойства оснований: Zn(OH)2 + H2SO4 ® ZnSO4 + 2H2O – с основаниями, проявляя свойства кислот: Zn(OH)2 + 2NaOH ® Na2ZnO2 +2 H2O (при сплавлении) Zn(OH) 2 + 2NaOH ® Na2[Zn(OH)4] (в растворе) |
КИСЛОТЫ
Кислоты - сложные вещества, состоящие из атомов водорода и кислотного остатка. (С точки зрения теории электролитической диссоциации: кислоты - электролиты, которые при диссоциации в качестве катионов образуют только ионы водорода H+ и анионы кислотного остатка).
Классификация
По составу:
бескислородные (НСl, НВr, НI, Н2S и др) и кислородсодержащие кислоты(Н2SО4, НNО3, Н3РО4 и др).
По числу атомов водорода, способных замещаться на металл:
одно-, двух-, трёхосновные...(например HCl, HNO3 – одноосновные, H2S, H2SO3, H2SiO 3 – двухосновные, H3PO4, Н3ВО3 – трёхосновные)
Номенклатура
Названия кислородсодержащих кислот производятся от названия неметалла с прибавлением окончаний –ная, -вая, если степень окисления его соответствует номеру группы. По мере понижения степени окисления суффиксы меняются в следующем порядке: -оватая, -истая, -оватистая:
HCl+7O4 - хлорная кислота
HCl+5O3 - хлорноватая кислота
HCl+3O2 - хлористая кислота
HCl+1O - хлорноватистая кислота
HN+5O3 - азотная кислота
HN+3O2 - азотистая кислота
Если элемент в одной и той же степени окисления образует несколько кислородсодержащих кислот, то к названию кислоты с меньшим содержанием кислородных атомов добавляется префикс «мета», при наибольшем числе - префикс «орто»:
НВ+3О2 – метаборная кислота HP+5O3 – метафосфорная кислота
Н3В+3О3 – ортоборная кислота H3P+5O4 – ортофосфорная кислота
Названия бескислородных кислот производятся от названия неметалла с окончанием -о и прибавлением слова водородная:
НF - фтороводородная или плавиковая кислота
НCl - хлороводородная или соляная кислота
Получение
1. Взаимодействие кислотного оксида с водой (для кислородсодержащих кислот):
SO3 + H2O ® H2SO4
2. Взаимодействие водорода с неметаллом и последующим растворением полученного продукта в воде (для бескислородных кислот):
H2 + Cl2 ® 2HCl
3. Реакциями обмена соли с кислотой
Ba(NO3)2 + H2SO4 ® BaSO4¯ + 2HNO3
в том числе, вытеснение слабых, летучих или малорастворимых кислот из солей более сильными кислотами:
Na2SiO3 + 2HCl ® H2SiO3¯ + 2NaCl
Химические свойства
1. Взаимодействие с основаниями (реакция нейтрализации):
2HNO3 + Ca(OH)2 ® Ca(NO3)2 + 2H2O
2. Взаимодействие с основными оксидами:
2HNO3 + CuO  Cu(NO3)2 + H2O
Cu(NO3)2 + H2O
3. Взаимодействие с металлами:
6HCl + 2Al ® 2AlCl3 + 3H2
(металлы, стоящие в ряду напряжений до водорода, кислоты-неокислители).
4. Взаимодействие с солями (реакции обмена), при которых выделяется газ или образуется осадок:
H2SO4 + BaCl2 ® BaSO4¯ +2HCl
2HCl + K2CO3 ® 2KCl + H2O + CO2
5. При нагревании кислоты разлагаются на кислотный оксид и воду:
H2SO4  SO3 + H2O
SO3 + H2O
6. В водных растворах кислоты диссоциируют на катионы водорода и анионы кислотных остатков:
H2SO4  H+ + HSO4– (I ступень)
H+ + HSO4– (I ступень)
HSO4–  H+ + SO4 2– (II ступень)
H+ + SO4 2– (II ступень)
Ионы водорода придают кислотам кислый вкус и изменяют окраску индикаторов. Никаких других катионов, кроме ионов водорода, кислоты не образуют.
7. Действие на индикаторы:
лакмус – красный,
метилоранж – розовый
СОЛИ
Соли - сложные вещества, которые состоят из атомов металла и кислотных остатков. Это наиболее многочисленный класс неорганических соединений.
Классификация
Соли принято делить на:
| Средние |
| Кислые |
| Основные |
| Двойные |
| Смешанные |
| Комплексные |
В средних солях все атомы водорода соответствующей кислоты замещены на ионы металла, в кислых солях они замещены только частично, в основных солях группы ОН соответствующего основания частично замещены на кислотные остатки.
Двойные соли содержат два разных катиона и один анион: СаСО3 ∙МgСО3 (доломит), КСl ∙ NaCl (сильвинит), КАl(SО4)2 (алюмокалиевые квасцы).
Смешанные со ли содержат один катион и два разных аниона: СаОСl2 (или Са(ОСl)Сl).
В состав комплексных солей входит комплексный ион, состоящий из центрального атома, связанного с несколькими лигандами: K4[Fе(СN)6] (желтая кровяная соль).
Гидратные сол и (кристаллогидраты) – это соли, в которых содержатся молекулы кристаллизационной воды: СuSО4∙5Н2О (медный купорос), Na2SO4∙10Н2О (глауберова соль).
Номенклатура
Название солей образуется из названия аниона в именительном падеже, за которым следует название катиона в родительном падеже.
Для солей бескислородных кислот к названию неметалла добавляется суффикс -ид, например хлорид натрия NаСl, сульфид железа(II) FeS и др.
При наименовании солей кислородсодержащих кислот к латинскому корню названия элемента добавляется окончание –ат (для высших степеней окисления), -ит для более низких. Для некоторых кислот используется приставка гипо- для низких степеней окисления неметалла. Для солей хлорной и марганцовой кислот используется приставка пер-: карбонат кальция СаСО3, сульфат железа (III) Fе2(SО4)3, сульфит железа (II) FеSО3, гипохлорит калия КОСl, хлорит калия КСlО2, хлорат калия КClO3, перхлорат калия КClO4, перманганат калия КMnО4, дихромат калия К2Сr2O7.
Кислые и основные соли можно рассматривать как продукт неполного превращения кислот и оснований. По международной номенклатуре атом водорода, входящий в состав кислой соли, обозначается приставкой гидро - а группа ОН – приставкой гидроксо-: NаНS – гидросульфид натрия, NаНSО3 – гидросульфит натрия, MgОНСl – гидроксохлорид магния, Аl(ОН)2Сl –дигидроксо-хлорид алюминия.
В названиях комплексных ионов сначала указываются лиганды. Название комплексного иона завершается названием металла с указанием соответствующей степени окисления (римскими цифрами в скобках).
В названиях комплексных катионов используются русские названия металлов, например: [Cu(NН3)4]Сl2 – хлорид тетраамминмеди (II), [Ад(NH3)2]2SO4 – сульфат диамминсеребра (I).
В названиях комплексных анионов используются латинские названия металлов с суффиксом -ат, например: К[Аl(ОН)4] – тетрагидроксоалюминат калия, Nа[Сr(ОН)4] – тетрагидроксохромат(III) натрия, К4[Fе(СN)6] – гексациано-феррат (II) калия.
Названия гидратных солей образуются двумя способами. Можно воспользоваться системой наименования комплексных катионов, описанной выше; например, медный купорос [Си(Н2О)4]SО4 ∙Н2O (или СuSО4 ∙5Н2O) в таком случае будет называться сульфат тетрааквомеди(II). Однако для наиболее известных гидратных солей чаще всего степень гидратации указывают численной приставкой к слову «гидрат», например: СuSO4∙5Н2O — пентагидрат сульфата меди (II), Na2SО4 ∙10Н2O — декагидрат сульфата натрия, СаСl2 ∙2Н2O —дигидрат хлорида кальция.
Получение
Соли тесно связаны со всеми остальными классами неорганических соединений и могут быть получены практически из любого класса. Соли бескислородных кислот, кроме того, могут быть получены при непосредственном взаимодействии металлов и неметаллов (Сl, S и т.д.).
Средние соли
Важнейшие способы получения средних солей в виде схемы представлены на рис. 1. Жирными линиями соединены классы неорг. веществ, представители которых, реагируя, образуют соли.
Не все эти способы применимы к каждой соли, например: соли бескислородных кислот нельзя получить, используя способы 3 и 5, а соли металлов, стоящих в ряду напряжений правее водорода нельзя получить, используя способ 2. И наоборот, существует множество способов получения отдельных солей, не включенных в этот перечень. Большинство способов получения солей основано на взаимодействии веществ с противоположными свойствами:

Рис.1. Способы получения средних солей.
Таким образом, соли можно получить 12 важнейшими способами:
1) при взаимодействии металлов с неметаллами:
2Na + Cl2 ® 2NaCl
2) при взаимодействии металлов с кислотами:
Zn + 2HCl ® ZnCl2 + H2
3) при взаимодействии основных оксидов с кислотными оксидами:
MgO + CO2 ® MgCO3
4) при взаимодействии основных оксидов с кислотами:
CuO + H2SO4  CuSO4 + H2O
CuSO4 + H2O
5) при взаимодействии кислотных оксидов с основаниями:
Ba(OH)2 + CO2 ® BaCO3¯ + H2O
6) при взаимодействии оснований с кислотами:
Ca(OH)2 + 2HCl ® CaCl2 + 2H2O
7) при взаимодействии неметаллов с основаниями:
2KOHконц + Cl2 ® KClр-р + KClOр-р + H2O.
8) при взаимодействии оснований с солями:
Ba(OH)2 + Na2SO4 ® 2NaOH + BaSO4¯
9) при взаимодействии металлов с солями:
Fe + CuSO4 ® FeSO4 + Cu
10) при взаимодействии кислот с солями:
MgCO3 + 2HCl ® MgCl2 + H2O + CO2
BaCl2 + H2SO4 ® BaSO4¯ + 2HCl
11) при взаимодействии неметаллов с солями:
2K2SO3 + O2 ® 2K2SO4 (в растворе, медленно);
12) при взаимодействии солей друг с другом:
3CaCl2 + 2Na3PO4 ® Ca3(PO4)2¯ + 6NaCl
Кислые соли
1) взаимодействие кислоты с недостатком основания:
KOH + H2SO4 ® KHSO4 + H2O
2) взаимодействие основания с избытком кислотного оксида:
Ca(OH)2 + 2CO2 ® Ca(HCO3)2
3) взаимодействие средней соли с кислотой:
Ca3(PO4)2 + 4H3PO4 ® 3Ca(H2PO4)2
Основные соли
1) гидролиз солей, образованных слабым основанием и сильной кислотой
ZnCl2 + H2O ® Zn(OH)Cl + HCl
2) добавление (по каплям) небольших количеств щелочей к растворам средних солей металлов:
AlCl3 + 2NaOH ® [Al(OH)2]Cl + 2NaCl
3) взаимодействие солей слабых кислот со средними солями
2MgCl2 + 2Na2CO3 + H2O ® [Mg(OH)]2CO3¯ + CO2 + 4NaCl
Химические свойства
Средние соли
1) растворимые соли могут реагировать с металлами:
2AgNO3 + Cu ® 2Ag + Cu(NO3)2
2) некоторые соли могут окисляться активными неметаллами:
2KI + Cl2 ® 2KCl + I2
3) растворимые соли могут реагировать с растворами щелочей:
Fe(NO3)3 + 3NaOH ® Fe(OH)3¯ + 3NaNO3
4) соли слабых кислот реагируют с сильными кислотами:
Na2SiO3 + 2HCl2 ® H2SiO3¯ + 2NaCl
5) в растворе соли могут реагировать между собой:
BaCl2 + Na2SO4 ® BaSO4¯ + 2NaCl,
AgNO3 + NaCl ®AgCl¯ + NaNO3
6) некоторые соли при нагревании легко разлагаются:
2KNO3  2KNO2 + O2,
2KNO2 + O2,
MgCO3  MgO + CO2,
MgO + CO2,
7) соли, имеющие в своём составе катион слабого основания или анион слабой кислоты, подвергаются гидролизу:
Al2S3 + 6H2O  2Al(OH)3¯ + 3H2S
2Al(OH)3¯ + 3H2S
FeCl3 + H2O  Fe(OH)Cl2 + HCl
Fe(OH)Cl2 + HCl
Na2S + H2O  NaHS +NaOH
NaHS +NaOH
8) некоторые соли вступают в окислительно-восстановительные реакции, обусловленные свойствами катиона или аниона.
2KMnO4 + 16HCl ® 2MnCl2 + 2KCl + 5Cl2 + 8H2O
Кислые соли
1) термическое разложение с образованием средней соли:
Ca(HCO3)2 ® CaCO3¯ + CO2 + H2O
2) взаимодействие со щёлочью (образование средней соли):
Ba(HCO3)2 + Ba(OH)2 ® 2BaCO3¯ + 2H2O
Основные соли
1) термическое разложение:
[Cu(OH)]2CO3(малахит) ® 2CuO + CO2 + H2O
2) взаимодействие с кислотой (образование средней соли):
Sn(OH)Cl + HCl  SnCl2 + H2O
SnCl2 + H2O
Генетическая связь
между различными классами соединений

|