| В 1 1. Определить энергию активации и предэкспонециальный множитель в уравнении Аррениуса для константы скорости реакции, значения которой при температурах 273 и 293 К равны соответственно 2,46 и 47,5 с-1. 2. При высокой температуре уксусная кислота разлагается по двум направлениям: CH3COOH ® CH4 + CO2 (1) CH3COOH ® CH2CO + H2O (2) Константа скорости и энергия активации реакции (1) при температуре 1189 К равны соответственно 3,74 с-1 и 155 000 Дж/моль; для реакции (2) соответственно - 4,65 с-1 и 184 000 Дж/моль. Рассчитать время, необходимое для того, чтобы уксусная кислота прореагировала на 99%, и максимальный выход кетена. | ||||||||||||||||||||||||||||||||||||||
| В 2 1. Определить энергию активации реакции, если при изменении температуры с 723 до 773 К ее скорость возрастает в 2,73 раза. 2. Протекает последовательная реакция первого порядкаА®R®S. Концентрация промежуточного продукта достигает максимального значения через 170 мин. Рассчитайте константы скоростей этих реакций, если х А = 0,4. | ||||||||||||||||||||||||||||||||||||||
| В 3 1. При температуре 748 К константа скорости реакции составляет 3,2·105 ч-1. Определить константу скорости при 793 К, если энергия активации реакции равна 87,9 кДж/моль. 2. Реакция А + В ®R + S проводится при температуре 507 К и начальной концентрации вещества А 0,05 кмоль/м3 в течение 40 мин. Константа скорости реакции равна 1,28 м3/кмоль∙мин). Оценить количественно влияние начального мольного соотношения реагентов (CA0:СB0 = 1:1;CA0:СB0 = 1:1,5; CA0:СB0 = 1:2) на достигаемую степень превращения вещества А. | ||||||||||||||||||||||||||||||||||||||
| В 4 1. Дана реакция 2А + ЗВ = S + 4R + 2F. Определить скорость расходования компонента В и скорость образования продуктов реакции, если скорость исчезновения компонента А составляет 5 моль в единицу времени на единицу объема. 2. Для обратимой реакции 2А «R, протекающей в газовой фазе при постоянном давлении, выразить изменение степени превращения вещества dxA/d t как функцию от степени превращения х A. Прямая реакция второго порядка, обратная - первого. | ||||||||||||||||||||||||||||||||||||||
| В 5 1. Константа скорости реакции равна 0,025 с-1. Исходная концентрация реагента составляет 1 кмоль/м3. Определить скорости реакции, протекающей в замкнутом объеме через 10, 20, 30, 40, 50 с. Определить порядок реакции и вычислить константу скорости. 2. Для последовательной реакции первого порядка А®R®Sрассчитайте CRmax, если: 1) k1>>k2; 2); k1 = k2 3) k1<<k2. | ||||||||||||||||||||||||||||||||||||||
В 6
1. Выразить скорость реакции гидролиза уксусного ангидрида при его взаимодействии с водой как функцию степени превращения уксусного ангидрида:
(СН3СО2)О + Н2О <=> 2СН3СООН.
Реакция проводится в большом избытке воды.
2. Для параллельной реакции
 с константами скоростей k1 = 10-2c-1 и k2 = 10-3c-1 определить время, при котором в продуктах будет содержаться 0,8 кмоль/м3 вещества R, концентрацию вещества S и степень превращения вещества А. Перед началом реакции концентрация вещества А была 1,4 кмоль/м3, а вещества R и S отсутствовали.
с константами скоростей k1 = 10-2c-1 и k2 = 10-3c-1 определить время, при котором в продуктах будет содержаться 0,8 кмоль/м3 вещества R, концентрацию вещества S и степень превращения вещества А. Перед началом реакции концентрация вещества А была 1,4 кмоль/м3, а вещества R и S отсутствовали.
| ||||||||||||||||||||||||||||||||||||||
В 7
1. Для реакции второго порядка 2А ®R + S определить степень превращения и скорость реакции через10, 30 и 50 с. Константа скорости равна 0,02 м3 (кмоль·с)-1, начальная концентрация веществаА – 2 кмоль/м3.
2. Хлорирование метилбензола дает смесь пара- и орто -изомеров в соответствии с реакционной схемой
С6Н5СН3 + С12® п -С6Н4С12 + НС1
С6Н5СН3 + С12® о -С6Н4С12 + НС1.
Экспериментально получены следующие результаты:
Учитывая, что обе реакции первого порядка, определить их константы. | ||||||||||||||||||||||||||||||||||||||
В 8
1. При температуре 456 К константа скорости реакции составляет 3,2·103 ч-1. Определить константу скорости при 793 К, если энергия активации реакции равна 187,9 кДж/моль.
1. Параллельную реакцию
 Можно осуществить в диапазоне температур от 500 до 700 К. При какой температуре должна протекать реакция, чтобы обеспечит образование максимального количества продукта R, если константы скоростей, с-1, описываются уравнениями k1 = 1015exp [-20000/(RT)], k2 = 1014exp [-10000/(RT)]. Ответ обосновать.
Можно осуществить в диапазоне температур от 500 до 700 К. При какой температуре должна протекать реакция, чтобы обеспечит образование максимального количества продукта R, если константы скоростей, с-1, описываются уравнениями k1 = 1015exp [-20000/(RT)], k2 = 1014exp [-10000/(RT)]. Ответ обосновать.
| ||||||||||||||||||||||||||||||||||||||
| В 9 1. Выразить скорость обратимой реакции А<=> 2R как функцию степени превращения. Реакция протекает в газовой фазе при постоянном давлении. 2. Протекает последовательная реакция первого порядка А®R®S. Максимальная концентрация продукта R при температуре 250 °С составляет 0,57 СА0. При какой температуре следует проводить реакции, чтобы CRmax ³ СA0? Энергия активации целевой реакции равна 48000 Дж/моль, побочной - 39 000 Дж/моль. При этом предэкспоненциальные множители в выражениях для констант скоростей обеих реакций примерно равны. | ||||||||||||||||||||||||||||||||||||||
| В 10 1. Выразить скорость необратимой реакции как функцию степени превращения исходных веществ для гомогенной реакции взаимодействия гидроксида натрия с этилацетатом NaOH + СН3СООС2Н5 =>CH3COONa + С2Н5ОН. 2. Проводится реакция А + В ®R с константой скорости k = 1∙102 л/(моль∙ч). Исходные концентрации веществ А и В равны по 0,08 моль/л. Найти время, необходимое для снижения концентрации веществ до 0,04 моль/л. | ||||||||||||||||||||||||||||||||||||||
В 11
1. Дана обратимая реакция Н2 + J2«2HJ. Определить время, необходимое для образования 1 моль HJ в реакторе вместимостью 1 лпри температуре 550 °С, если исходная смесь состоит из 2 моль водорода и 1 моль йода. При данной температуре константа скорости прямой реакции равна 1,25∙10-4 л/(моль∙с), а константа скорости обратной реакции - 0,25∙10-4л/(моль∙с).
2. Для параллельной реакции
 с константами скоростей k1 = 10-2c-1 и k2 = 10-3c-1 определить время, при котором в продуктах будет содержаться 0,8 кмоль/м3 вещества R, концентрацию вещества S и степень превращения вещества А. Перед началом реакции концентрация вещества А была 1,4 кмоль/м3, а вещества R и S отсутствовали.
с константами скоростей k1 = 10-2c-1 и k2 = 10-3c-1 определить время, при котором в продуктах будет содержаться 0,8 кмоль/м3 вещества R, концентрацию вещества S и степень превращения вещества А. Перед началом реакции концентрация вещества А была 1,4 кмоль/м3, а вещества R и S отсутствовали.
| ||||||||||||||||||||||||||||||||||||||
| В 12 1. Для обратимой экзотермической реакции A«R+ Qр зависимость константы равновесия от температуры задана в виде lnKp= 9000/T-27. Экспериментально установлено, что при температуре 30 °С за время 1140 с степень превращения вещества А хА = 0,79, при 40 °С за 480 с - хА = 0,65. Построить зависимость степени превращения вещества А от температуры и определить оптимальную температуру, при которой достигается максимальная степень превращения, если продолжительность реакции составляет 300 с. 2. Реакция А + В ®R + S проводится при температуре 700 К и начальной концентрации вещества А 0,05 кмоль/м3 в течение 20 мин. Константа скорости реакции равна 1,28 (м3/кмоль∙мин). Оценить количественно влияние начального мольного соотношения реагентов (CA0:СB0 = 1:1;CA0:СB0 = 1:1,5; CA0:СB0 = 1:2) на достигаемую степень превращения вещества А. | ||||||||||||||||||||||||||||||||||||||
В 13
1. При постоянной температуре протекает параллельная реакция
 с константами скоростей k1 = 10-3 с-1 и k2 = 10-2 с-1. Перед началом реакции СА0 = 2 моль/м3, CR0 = CSo = 0. Определить значение скорости превращения реагента А и продукта S в момент времени, когда CR = 0,05 кмоль/м3, CS = 0,5 кмоль/м3. Каким будет это время?
2.Вычислить время, за которое достигается максимальная концентрация целевого продукта R в последовательной реакции А®R®S. Константы скоростей k1 = 2 c-1 и k2 — 5 с-1, в начале реакции с константами скоростей CA0 = 1 кмоль/м3, СS0 = и CR0 = 0.
Какими при этом будут степень превращения вещества А и селективность по продукту R?
с константами скоростей k1 = 10-3 с-1 и k2 = 10-2 с-1. Перед началом реакции СА0 = 2 моль/м3, CR0 = CSo = 0. Определить значение скорости превращения реагента А и продукта S в момент времени, когда CR = 0,05 кмоль/м3, CS = 0,5 кмоль/м3. Каким будет это время?
2.Вычислить время, за которое достигается максимальная концентрация целевого продукта R в последовательной реакции А®R®S. Константы скоростей k1 = 2 c-1 и k2 — 5 с-1, в начале реакции с константами скоростей CA0 = 1 кмоль/м3, СS0 = и CR0 = 0.
Какими при этом будут степень превращения вещества А и селективность по продукту R?
| ||||||||||||||||||||||||||||||||||||||
В 14
1. Для обратимой реакции А«R первого порядка определить константы скоростей, исходя из следующих данных:
Время, мин 0 19 38 ∞
Степень превращения 2 6,9 10,4 21,2
вещества А, %
2. Две параллельные реакции
a1 A + b1 B = rR + sS(целевая реакция)
a2 A + b2 B = yY +zZ(побочная реакция) характеризуются кинетическими уравнениями

 и энергиями активации Е1 = 45 кДж/моль, Е2 = 65 кДж/моль. Проанализируйте зависимость дифференциальной селективности для такой системы реакций от: а) концентрации реагентов А и В; б) температуры. Какие можно дать рекомендации по выбору технологического режима для этого процесса?
и энергиями активации Е1 = 45 кДж/моль, Е2 = 65 кДж/моль. Проанализируйте зависимость дифференциальной селективности для такой системы реакций от: а) концентрации реагентов А и В; б) температуры. Какие можно дать рекомендации по выбору технологического режима для этого процесса?
| ||||||||||||||||||||||||||||||||||||||
| В -15 1. Для обратимой реакции A«R начальный момент времени парциальное давление реагента А составляет 1,275∙10-4 Па, а вещества R- 0. Через 10 мин парциальное давление реагента А стало 5,2∙103 Па, а вещества R – 7,554∙103 Па. Рассчитать парциальное давление реагента А через 20 и 40 мин, если отношение k1/k-1 = 3. 2. При проведении последовательной реакции типа А®R®S в изотермических условиях степень превращения реагента составила 0,9. Определить дифференциальную и интегральную селективности по целевому продукту R, если k1 = 0,2 с-1, k2 = 0,1 с-1. | ||||||||||||||||||||||||||||||||||||||
В 16
1. При изотермическом проведении параллельной реакции
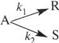 константы скоростей k 1 = 0,175 мин-1 и k2 = 0,025 мин-1. Рассчитать состав реакционной смеси и селективность по целевому продукту S через 10 мин после начала реакции, если исходная концентрация реагента равна 1,75 моль/л.
2. Газофазная реакцияА®R + S проводится при постоянном давлении и постоянное температуре. В исходной смеси содержится 100 % вещества А. Равновесная степень превращения составляет 0,6. Как увеличить степень превращения до 0,8, не меняя давления и температуры?
температуре 507 К и начальной концентрации вещества А 0,05 кмоль/м3 в течение 40 мин.
константы скоростей k 1 = 0,175 мин-1 и k2 = 0,025 мин-1. Рассчитать состав реакционной смеси и селективность по целевому продукту S через 10 мин после начала реакции, если исходная концентрация реагента равна 1,75 моль/л.
2. Газофазная реакцияА®R + S проводится при постоянном давлении и постоянное температуре. В исходной смеси содержится 100 % вещества А. Равновесная степень превращения составляет 0,6. Как увеличить степень превращения до 0,8, не меняя давления и температуры?
температуре 507 К и начальной концентрации вещества А 0,05 кмоль/м3 в течение 40 мин.
| ||||||||||||||||||||||||||||||||||||||
В 17
1. Параллельную реакцию
 Можно осуществить в диапазоне температур от 500 до 700 К. При какой температуре должна протекать реакция, чтобы обеспечит образование максимального количества продукта R, если константы скоростей, с-1, описываются уравнениями k1 = 1015exp [-20000/(RT)], k2 = 1014exp [-10000/(RT)]. Ответ обосновать.
2. Проводится реакция А + В ®R с константой скорости k = 1∙103 л/(моль∙ч). Исходные концентрации веществ А и В равны по 1,00 моль/л. Найти время, необходимое для снижения концентрации веществ до 0,01 моль/л.
Можно осуществить в диапазоне температур от 500 до 700 К. При какой температуре должна протекать реакция, чтобы обеспечит образование максимального количества продукта R, если константы скоростей, с-1, описываются уравнениями k1 = 1015exp [-20000/(RT)], k2 = 1014exp [-10000/(RT)]. Ответ обосновать.
2. Проводится реакция А + В ®R с константой скорости k = 1∙103 л/(моль∙ч). Исходные концентрации веществ А и В равны по 1,00 моль/л. Найти время, необходимое для снижения концентрации веществ до 0,01 моль/л.
| ||||||||||||||||||||||||||||||||||||||
| В 18 1. Для обратимой реакции 2А «R, протекающей в газовой фазе при постоянном давлении, выразить изменение степени превращения вещества dxA/d t как функцию от степени превращения х A. Прямая реакция второго порядка, обратная - первого. 2. Для обратимой реакции этерификации этилового спирта с концентрацией 56,5 % массовых долей с помощью муравьиной кислоты с концентрацией 0,07 моль/л k 1 = 1,85·10-3 с-1 и k-1 = 0,85·10-3 с-1. Определите равновесную концентрацию муравьиной кислоты и время, необходимое для того, чтобы этерификация прошла на 90%. | ||||||||||||||||||||||||||||||||||||||
| В 19 1. Для обратимой реакции А«R первого порядка определить константы скоростей, исходя из следующих данных: Время, мин 0 19 38 ∞ Степень превращения 2 6,9 10,4 21,2 вещества А, % 2. Проводится реакция А + В ®R с константой скорости k = 1∙102 л/(моль∙ч). Исходные концентрации веществ А и В равны по 0,08 моль/л. Найти время, необходимое для снижения концентрации веществ до 0,04 моль/л. | ||||||||||||||||||||||||||||||||||||||
В 20
2. Для последовательной реакции первого порядка А®R®Sрассчитайте CRmax, если: 1) k1>>k2; 2); k1 = k2 3) k1<<k2.
2. Две параллельные реакции
a1 A + b1 B = rR + sS(целевая реакция)
a2 A + b2 B = yY +zZ(побочная реакция) характеризуются кинетическими уравнениями

 и энергиями активации Е1 = 45 кДж/моль, Е2 = 65 кДж/моль. Проанализируйте зависимость дифференциальной селективности для такой системы реакций от: а) концентрации реагентов А и В; б) температуры. Какие можно дать рекомендации по выбору технологического режима для этого процесса?
и энергиями активации Е1 = 45 кДж/моль, Е2 = 65 кДж/моль. Проанализируйте зависимость дифференциальной селективности для такой системы реакций от: а) концентрации реагентов А и В; б) температуры. Какие можно дать рекомендации по выбору технологического режима для этого процесса?
| ||||||||||||||||||||||||||||||||||||||
| В 21 1. Для обратимой экзотермической реакции A«R+ Qр зависимость константы равновесия от температуры задана в виде lnKp= 9000/T-27. Экспериментально установлено, что при температуре 30 °С за время 1140 с степень превращения вещества А хА = 0,79, при 40 °С за 480 с - хА = 0,65. Построить зависимость степени превращения вещества А от температуры и определить оптимальную температуру, при которой достигается максимальная степень превращения, если продолжительность реакции составляет 300 с. 2. При высокой температуре уксусная кислота разлагается по двум направлениям: CH3COOH ® CH4 + CO2 (1) CH3COOH ® CH2CO + H2O (2) Константа скорости и энергия активации реакции (1) при температуре 1189 К равны соответственно 3,74 с-1 и 155 000 Дж/моль; для реакции (2) соответственно - 4,65 с-1 и 184 000 Дж/моль. Рассчитать время, необходимое для того, чтобы уксусная кислота прореагировала на 99%, и максимальный выход кетена. | ||||||||||||||||||||||||||||||||||||||
В 22
1. При изотермическом проведении параллельной реакции
 константы скоростей k 1 = 0,175 мин-1 и k2 = 0,025 мин-1. Рассчитать состав реакционной смеси и селективность по целевому продукту S через 10 мин после начала реакции, если исходная концентрация реагента равна 1,75 моль/л.
2. Протекает последовательная реакция первого порядка А®R®S. Концентрация промежуточного продукта достигает максимального значения через 170 мин. Рассчитайте константы скоростей этих реакций, если х А = 0,4.
константы скоростей k 1 = 0,175 мин-1 и k2 = 0,025 мин-1. Рассчитать состав реакционной смеси и селективность по целевому продукту S через 10 мин после начала реакции, если исходная концентрация реагента равна 1,75 моль/л.
2. Протекает последовательная реакция первого порядка А®R®S. Концентрация промежуточного продукта достигает максимального значения через 170 мин. Рассчитайте константы скоростей этих реакций, если х А = 0,4.
| ||||||||||||||||||||||||||||||||||||||
В 23
2. Для параллельной реакции
 с константами скоростей k1 = 10-2c-1 и k2 = 10-3c-1 определить время, при котором в продуктах будет содержаться 0,8 кмоль/м3 вещества R, концентрацию вещества S и степень превращения вещества А. Перед началом реакции концентрация вещества А была 1,4 кмоль/м3, а вещества R и S отсутствовали
2. Газофазная реакция А®R + S проводится при постоянном давлении и постоянное температуре. В исходной смеси содержится 100 % вещества А. Равновесная степень превращения составляет 0,6. Как увеличить степень превращения до 0,8, не меняя давления и температуры?
температуре 507 К и начальной концентрации вещества А 0,05 кмоль/м3 в течение 40 мин.
с константами скоростей k1 = 10-2c-1 и k2 = 10-3c-1 определить время, при котором в продуктах будет содержаться 0,8 кмоль/м3 вещества R, концентрацию вещества S и степень превращения вещества А. Перед началом реакции концентрация вещества А была 1,4 кмоль/м3, а вещества R и S отсутствовали
2. Газофазная реакция А®R + S проводится при постоянном давлении и постоянное температуре. В исходной смеси содержится 100 % вещества А. Равновесная степень превращения составляет 0,6. Как увеличить степень превращения до 0,8, не меняя давления и температуры?
температуре 507 К и начальной концентрации вещества А 0,05 кмоль/м3 в течение 40 мин.
| ||||||||||||||||||||||||||||||||||||||
В 24
1. Дана обратимая реакция Н2 + J2«2HJ. Определить время, необходимое для образования 1 моль HJ в реакторе вместимостью 1 лпри температуре 550 °С, если исходная смесь состоит из 2 моль водорода и 1 моль йода. При данной температуре константа скорости прямой реакции равна 1,25∙10-4 л/(моль∙с), а константа скорости обратной реакции - 0,25∙10-4л/(моль∙с).
2. Для параллельной реакции
 с константами скоростей k1 = 10-2c-1 и k2 = 10-3c-1 определить время, при котором в продуктах будет содержаться 0,8 кмоль/м3 вещества R, концентрацию вещества S и степень превращения вещества А. Перед началом реакции концентрация вещества А была 1,4 кмоль/м3, а вещества R и S отсутствовали.
с константами скоростей k1 = 10-2c-1 и k2 = 10-3c-1 определить время, при котором в продуктах будет содержаться 0,8 кмоль/м3 вещества R, концентрацию вещества S и степень превращения вещества А. Перед началом реакции концентрация вещества А была 1,4 кмоль/м3, а вещества R и S отсутствовали.
| ||||||||||||||||||||||||||||||||||||||
| В 25 1. Для обратимой экзотермической реакции A«R+ Qр зависимость константы равновесия от температуры задана в виде lnKp= 9000/T-27. Экспериментально установлено, что при температуре 30 °С за время 1140 с степень превращения вещества А хА = 0,79, при 40 °С за 480 с - хА = 0,65. Построить зависимость степени превращения вещества А от температуры и определить оптимальную температуру, при которой достигается максимальная степень превращения, если продолжительность реакции составляет 300 с. 2. Реакция А + В ®R + S проводится при температуре 700 К и начальной концентрации вещества А 0,05 кмоль/м3 в течение 20 мин. Константа скорости реакции равна 1,28 (м3/кмоль∙мин). Оценить количественно влияние начального мольного соотношения реагентов (CA0:СB0 = 1:1;CA0:СB0 = 1:1,5; CA0:СB0 = 1:2) на достигаемую степень превращения вещества А. | ||||||||||||||||||||||||||||||||||||||
В 26
1. При постоянной температуре протекает параллельная реакция
 с константами скоростей k1 = 10-3 с-1 и k2 = 10-2 с-1. Перед началом реакции СА0 = 2 моль/м3, CR0 = CSo = 0. Определить значение скорости превращения реагента А и продукта S в момент времени, когда CR = 0,05 кмоль/м3, CS = 0,5 кмоль/м3. Каким будет это время?
2.Вычислить время, за которое достигается максимальная концентрация целевого продукта R в последовательной реакции А®R®S. Константы скоростей k1 = 2 c-1 и k2 — 5 с-1, в начале реакции с константами скоростей CA0 = 1 кмоль/м3, СS0 = и CR0 = 0.
Какими при этом будут степень превращения вещества А и селективность по продукту R?
с константами скоростей k1 = 10-3 с-1 и k2 = 10-2 с-1. Перед началом реакции СА0 = 2 моль/м3, CR0 = CSo = 0. Определить значение скорости превращения реагента А и продукта S в момент времени, когда CR = 0,05 кмоль/м3, CS = 0,5 кмоль/м3. Каким будет это время?
2.Вычислить время, за которое достигается максимальная концентрация целевого продукта R в последовательной реакции А®R®S. Константы скоростей k1 = 2 c-1 и k2 — 5 с-1, в начале реакции с константами скоростей CA0 = 1 кмоль/м3, СS0 = и CR0 = 0.
Какими при этом будут степень превращения вещества А и селективность по продукту R?
| ||||||||||||||||||||||||||||||||||||||
В 27
1. Для обратимой реакции А«R первого порядка определить константы скоростей, исходя из следующих данных:
Время, мин 0 19 38 ∞
Степень превращения 2 6,9 10,4 21,2
вещества А, %
2. Две параллельные реакции
a1 A + b1 B = rR + sS(целевая реакция)
a2 A + b2 B = yY +zZ(побочная реакция) характеризуются кинетическими уравнениями

 и энергиями активации Е1 = 45 кДж/моль, Е2 = 65 кДж/моль. Проанализируйте зависимость дифференциальной селективности для такой системы реакций от: а) концентрации реагентов А и В; б) температуры. Какие можно дать рекомендации по выбору технологического режима для этого процесса?
и энергиями активации Е1 = 45 кДж/моль, Е2 = 65 кДж/моль. Проанализируйте зависимость дифференциальной селективности для такой системы реакций от: а) концентрации реагентов А и В; б) температуры. Какие можно дать рекомендации по выбору технологического режима для этого процесса?
| ||||||||||||||||||||||||||||||||||||||
| В -28 1. Для обратимой реакции A«R начальный момент времени парциальное давление реагента А составляет 1,275∙10-4 Па, а вещества R- 0. Через 10 мин парциальное давление реагента А стало 5,2∙103 Па, а вещества R – 7,554∙103 Па. Рассчитать парциальное давление реагента А через 20 и 40 мин, если отношение k1/k-1 = 3. 2. При проведении последовательной реакции типа А®R®S в изотермических условиях степень превращения реагента составила 0,9. Определить дифференциальную и интегральную селективности по целевому продукту R, если k1 = 0,2 с-1, k2 = 0,1 с-1. | ||||||||||||||||||||||||||||||||||||||
В 29
1. При изотермическом проведении параллельной реакции
 константы скоростей k 1 = 0,175 мин-1 и k2 = 0,025 мин-1. Рассчитать состав реакционной смеси и селективность по целевому продукту S через 10 мин после начала реакции, если исходная концентрация реагента равна 1,75 моль/л.
2. Газофазная реакцияА®R + S проводится при постоянном давлении и постоянное температуре. В исходной смеси содержится 100 % вещества А. Равновесная степень превращения составляет 0,6. Как увеличить степень превращения до 0,8, не меняя давления и температуры?
температуре 507 К и начальной концентрации вещества А 0,05 кмоль/м3 в течение 40 мин.
константы скоростей k 1 = 0,175 мин-1 и k2 = 0,025 мин-1. Рассчитать состав реакционной смеси и селективность по целевому продукту S через 10 мин после начала реакции, если исходная концентрация реагента равна 1,75 моль/л.
2. Газофазная реакцияА®R + S проводится при постоянном давлении и постоянное температуре. В исходной смеси содержится 100 % вещества А. Равновесная степень превращения составляет 0,6. Как увеличить степень превращения до 0,8, не меняя давления и температуры?
температуре 507 К и начальной концентрации вещества А 0,05 кмоль/м3 в течение 40 мин.
| ||||||||||||||||||||||||||||||||||||||
В 30
1. Параллельную реакцию
 Можно осуществить в диапазоне температур от 500 до 700 К. При какой температуре должна протекать реакция, чтобы обеспечит образование максимального количества продукта R, если константы скоростей, с-1, описываются уравнениями k1 = 1015exp [-20000/(RT)], k2 = 1014exp [-10000/(RT)]. Ответ обосновать.
2. Проводится реакция А + В ®R с константой скорости k = 1∙103 л/(моль∙ч). Исходные концентрации веществ А и В равны по 1,00 моль/л. Найти время, необходимое для снижения концентрации веществ до 0,01 моль/л.
Можно осуществить в диапазоне температур от 500 до 700 К. При какой температуре должна протекать реакция, чтобы обеспечит образование максимального количества продукта R, если константы скоростей, с-1, описываются уравнениями k1 = 1015exp [-20000/(RT)], k2 = 1014exp [-10000/(RT)]. Ответ обосновать.
2. Проводится реакция А + В ®R с константой скорости k = 1∙103 л/(моль∙ч). Исходные концентрации веществ А и В равны по 1,00 моль/л. Найти время, необходимое для снижения концентрации веществ до 0,01 моль/л.
| ||||||||||||||||||||||||||||||||||||||
| В 31 1. Для обратимой реакции 2А «R, протекающей в газовой фазе при постоянном давлении, выразить изменение степени превращения вещества dxA/d t как функцию от степени превращения х A. Прямая реакция второго порядка, обратная - первого. 2. Для обратимой реакции этерификации этилового спирта с концентрацией 56,5 % массовых долей с помощью муравьиной кислоты с концентрацией 0,07 моль/л k 1 = 1,85·10-3 с-1 и k-1 = 0,85·10-3 с-1. Определите равновесную концентрацию муравьиной кислоты и время, необходимое для того, чтобы этерификация прошла на 90%. | ||||||||||||||||||||||||||||||||||||||
| В 32 1. Для обратимой реакции А«R первого порядка определить константы скоростей, исходя из следующих данных: Время, мин 0 19 38 ∞ Степень превращения 2 6,9 10,4 21,2 вещества А, % 2. Проводится реакция А + В ®R с константой скорости k = 1∙102 л/(моль∙ч). Исходные концентрации веществ А и В равны по 0,08 моль/л. Найти время, необходимое для снижения концентрации веществ до 0,04 моль/л. | ||||||||||||||||||||||||||||||||||||||
В 33
2. Для последовательной реакции первого порядка А®R®Sрассчитайте CRmax, если: 1) k1>>k2; 2); k1 = k2 3) k1<<k2.
2. Две параллельные реакции
a1 A + b1 B = rR + sS(целевая реакция)
a2 A + b2 B = yY +zZ(побочная реакция) характеризуются кинетическими уравнениями

 и энергиями активации Е1 = 45 кДж/моль, Е2 = 65 кДж/моль. Проанализируйте зависимость дифференциальной селективности для такой системы реакций от: а) концентрации реагентов А и В; б) температуры. Какие можно дать рекомендации по выбору технологического режима для этого процесса?
и энергиями активации Е1 = 45 кДж/моль, Е2 = 65 кДж/моль. Проанализируйте зависимость дифференциальной селективности для такой системы реакций от: а) концентрации реагентов А и В; б) температуры. Какие можно дать рекомендации по выбору технологического режима для этого процесса?
|