1)бак метод,этап изучения ч.к. гемофильных и анаэробных бактерий;2)определение чувствительности к антибиотикам способом дисков на плотной среде 5% кровяной агар, с гемином;3)вокруг дисков видны зоны торможения роста бактерии различного диаметра, в зависимости от степени чувствитеольтности: различают три вида: чуствительны, умеренно резистетнтые, резистентные 4)способ серийных разведений антибиотиков,кассетный микрометод,Е-тест и определение геноы резистентности с помощью ПЦР,5)анаэробные виды чувст. К производным имидазола,аминопенициллинам и цефалоспоринам;в отличие от др. анаэробов фузобактерии обычно устойчивы к линомицину и эритромицину;антибиотки группы аминогликозидов не имеют мишеней в клетке облигатных анаэробных бактерий и потому используются в качестве селективных добавок к пит.средам (канамицин,гентамицин).
 3.44 Препарат «Бета-гемолитический стрептококк на кровяном агаре».
3.44 Препарат «Бета-гемолитический стрептококк на кровяном агаре».
1)Бак. метод, получение изолированных колоний на плотной универсальной среде; Морфология. Стрептококки (от греч. streptos — цепочка и coccus — зерно) — грамположительные цитохромнегативные бактерии шаровидной или овоидной формы, растущие чаще в виде цепочек, преимущественно неподвижные, не имеют спор. Патогенные виды образуют капсулу (у пневмококка имеет диагностическое значение). Факультативные (большинство) или строгие анаэробы.
Культуральные свойства. Стрептококки плохо растут на простых питательных средах. Обычно используют среды с кровью или сывороткой крови. Чаще применяют сахарный бульон и кровяной агар, содержащий 5% дефибринированной крови. На бульоне рост придонно — пристеночный в виде крошковатого осадка, бульон чаще прозрачен. На плотных средах чаще образуют очень мелкие колонии. Оптимум температуры +37о С, рН — 7,2-7,6. На плотных средах стрептококки группы А образуют колонии трех типов:
|
|
- мукоидные (напоминают капельку воды) — характерны для вирулентных штаммов, имеющих капсулу;
- шероховатые — плоские, с неровной поверхностью и фестончатыми краями — характерны для вирулентных штаммов, имеющих М- антигены;
- гладкие — характерны для маловирулентных штаммов. 2)кровяной агар;3) бета-гемолиз вокруг колонии;4) б/х и серолог. Идентификация по групповому С-антигену и типоспецифич.Т-антигенам;5); воспалит.заболевания различных органов итканей,ревматизм,скарлатина,рожистое воспалление
 3.45 Препарат «Альфа-гемолитический стрептококк на кровяном агаре».
3.45 Препарат «Альфа-гемолитический стрептококк на кровяном агаре».
1,2,3)Бак. метод, получение изолированных колоний на плотной универсальной среде Бета — гемолитические стрептококки при росте на кровяном агаре образуют вокруг колонии четкую зону гемолиза, альфа — гемолитические — частичный гемолиз и позеленение среды (превращение окси- в метгемоглобин), гамма- гемолитические — на кровяном агаре гемолиза незаметно. Альфа — гемолитические стрептококки за зеленый цвет среды называют S.viridans (зеленящими).; Бак. метод, получение изолированных колоний на плотной универсальной среде; Морфология. Стрептококки (от греч. streptos — цепочка и coccus — зерно) — грамположительные цитохромнегативные бактерии шаровидной или овоидной формы, растущие чаще в виде цепочек, преимущественно неподвижные, не имеют спор. Патогенные виды образуют капсулу (у пневмококка имеет диагностическое значение). Факультативные (большинство) или строгие анаэробы.
|
|
Культуральные свойства. Стрептококки плохо растут на простых питательных средах. Обычно используют среды с кровью или сывороткой крови. Чаще применяют сахарный бульон и кровяной агар, содержащий 5% дефибринированной крови. На бульоне рост придонно — пристеночный в виде крошковатого осадка, бульон чаще прозрачен. На плотных средах чаще образуют очень мелкие колонии. Оптимум температуры +37о С, рН — 7,2-7,6. На плотных средах стрептококки группы А образуют колонии трех типов:
- мукоидные (напоминают капельку воды) — характерны для вирулентных штаммов, имеющих капсулу;
- шероховатые — плоские, с неровной поверхностью и фестончатыми краями — характерны для вирулентных штаммов, имеющих М- антигены;
- гладкие — характерны для маловирулентных штаммов;4)альфа-гемолиз вокруг колонии;5) б/х и серолог. идентификация; полный и частичный гемолиз на кровяном агаре.
 3.46 Препарат «Колонии биотипа «mitis» на теллуритовом агаре».
3.46 Препарат «Колонии биотипа «mitis» на теллуритовом агаре».
1,2)Бак. метод; получение изолированных колоний на плотной селективной среде; 3)S-колонии черного цвета в рез-те восстановления металич.теллура; 4)окраска по Нейссеру, б/х идентификация(проба ПИЗУ), определение токсигенности; 5)лизогения совместное существование бактерий и бактериофагов, при котором бактериофаг является составной частью нормально развивающейся бактериальной клетки. При лизогении нуклеиновая кислота бактериофага включается в состав хромосомы бактерии и воспроизводится вместе с ней. Образуются белки, придающие бактерии-хозяину ряд новых свойств, например меняют ее вирулентность, чувствительность к антибиотикам или другим бактериофагам. Фаговые частицы не образуются. и лизогенная конверсия У других бактерий присутствие профага вызывает изменение морфологии или антигенных свойств. Такое изменение генетических свойств, вызванное вирусной ДНК, обозначают терми нами «инфекционная наследственность» или «лизогенная (фаговая) конверсия».
|
|
при участии умеренного бактериофага.
 3.47 Препарат «Колонии микобактерий на яичной среде».
3.47 Препарат «Колонии микобактерий на яичной среде».
1)Бак. метод; получение изолированных колоний на плотной оптимальной среде; 2)яичная среда,среда Левенштейна-Йенсена 3)колонии с жёлтым пигментом – вариант RВ бактериальной клетке дифференцируется:
клеточная стенка — состоящая из 3—4 связанных слоёв толщиной до 200—250 нм, содержит специфичные воска (микозиды) полисахариды, защищает микобактерию от воздействия внешней среды, обладает антигенными свойствами и проявляет серологическую активность; ограничивает микобактерию снаружи, обеспечивает стабильность размеров и формы клетки, механическую, осмотическую и химическую защиту, включает факторы вирулентности — липополисахариды, с фосфатидной фракцией которых связывают вирулентность микобактерий;
бактериальная цитоплазма; может содержать гранулы;цитоплазматическая мембрана — включает липопротеиновые комплексы, ферментные системы, формирует внутрицитоплазматическую мембранную систему (мезосому);
ядерная субстанция — состоит из одной кольцевой ДНК.Белки (туберкулопротеиды) являются главными носителями антигенных свойств МБТ и проявляют специфичность в реакциях повышенной чувствительности замедленного типа. К этим белкам относится туберкулин. С полисахаридами связано обнаружение антител в сыворотке крови больных туберкулёзом. Липидные фракции способствуют устойчивости микобактерий к кислотам и щелочам..;4) б/х идентификация, определение чувствительности к антибиотикам,ПЦР; 5)производные ПАСК, стрептомицин, аминогликозиды, рифампицин, фторхинолоны.
 3.48 Препарат «Колонии микобактерий на среде Левенштейна-Йенсена».
3.48 Препарат «Колонии микобактерий на среде Левенштейна-Йенсена».
1)Бак. метод; получение изолированных колоний на плотной селективной среде во флаконе; колонии с жёлтым пигментом – вариант RВ бактериальной клетке дифференцируется:клеточная стенка — состоящая из 3—4 связанных слоёв толщиной до 200—250 нм, содержит специфичные воска (микозиды) полисахариды, защищает микобактерию от воздействия внешней среды, обладает антигенными свойствами и проявляет серологическую активность; ограничивает микобактерию снаружи, обеспечивает стабильность размеров и формы клетки, механическую, осмотическую и химическую защиту, включает факторы вирулентности — липополисахариды, с фосфатидной фракцией которых связывают вирулентность микобактерий;
бактериальная цитоплазма; может содержать гранулы;цитоплазматическая мембрана — включает липопротеиновые комплексы, ферментные системы, формирует внутрицитоплазматическую мембранную систему (мезосому);ядерная субстанция — состоит из одной кольцевой ДНК.Белки (туберкулопротеиды) являются главными носителями антигенных свойств МБТ и проявляют специфичность в реакциях повышенной чувствительности замедленного типа. К этим белкам относится туберкулин. С полисахаридами связано обнаружение антител в сыворотке крови больных туберкулёзом. Липидные фракции способствуют устойчивости микобактерий к кислотам и щелочам.; б/х идентификация, определение чувствительности к антибиотикам.5)Вызывающие туберкулез виды микобактерий объединены в комплекс М. tuberculosis, включающий М. tuberculosis, М. bovis, М. bovis BCG, М. africanum, М. microti, М. canettii. В последнее время к нему отнесены М. pinnipedii, М. caprae, филогенетически имеющие отношение к М. microti и М. bovis.Остальные микобактерии, вызывающие различные микобактериозы, отнесены к группе нетуберкулезных микобактерий. Из этой группы выделяют следующие комплексы: М. avium, состоящий из М. avium, М. intracellulare, М. scrofulaceum; M. fortuitum включающий подвиды M. fortuitum и М. chelonae, и М. terrae, включающий М. terrae, М. triviale и М. nonchromogenicum. Важнейшие группы составляют возбудители проказы М. leprae, а также возбудители язвенных поражений Buruli М. ulcerans.
 3.49 Препарат «Колонии бацилл на кровяном агаре».
3.49 Препарат «Колонии бацилл на кровяном агаре».
Бак. метод, получение изолированных колоний на плотной универсальной среде; R-колонии с бета-гемолизом; окраска по Ожешко, б/х идентификация; бацилла сибирской язвы. Грамположительны. Микроб неподвижен, окружен прозрачной капсулой, образование которой характерно для вирулентных штаммов. Капсула образуется как в организме больных людей и животных, так и при культивировании на специальных питательных средах. В неблагоприятных условиях внешней среды при доступе кислорода и температуре от 15 до 42°С микроб образует спору, которая располагается центрально и имеет овальную форму. Диаметр ее не превышает поперечника клетки. При попадании в благоприятную среду споры прорастают в течение нескольких часов.
Возбудитель сибирской язвы относится к факультативным аэробам. Оптимальная температура роста 35— 37°С и рН 7,4—8,0. Микроб нетребователен к питательным средам, поэтому может расти даже на таких субстратах, как настой соломы, сырой и вареный картофель, экстракты злаков, гороха и др. На мясо-пептонном агаре рост настолько характерен, что имеет диагностическое значение. Через 24 ч роста появляются колонии: серебристо-серые, зернистые, диаметром 3—5 мм, с бахромчатыми краями и отходящими от них пучками нитей, напоминающими голову медузы или львиную гриву. Такой рост (R-форма) характерен для вирулентных штаммов. Биохимическая активность невелика: разлагает глюкозу, мальтозу, сахарозу с образованием кислоты, молоко медленно свертывает и пептонизирует. Характерен рост в столбике желатина: в виде «опрокинутой елочки», позже желатин воронкоооразно разжижается; на кровяном агape не дает гемолиза, чем отличается от сходных с ним почвенных и ложносибиреязвенных бацилл. Патогенетическими факторами возбудителя сибирской язвы являются его способность продуцировать экзотоксин и образовывать капсулу. С экзотоксином связывают воспалительное и летальное действие возбудителя. Обнаружено, что токсин также подавляет фагоцитарную активность лейкоцитов. Капсула препятствует фагоцитозу бацилл, способствуя проявлению действия основного патогенетического фактора — токсина. Токсин вызывает в организме повышение проницаемости сосудов, расстройство дыхания вследствие поражения центральной нервной системы, изменяет клеточный и химический состав крови. Микробиологическая диагностика. В лабораторию направляют патологический материал, взятый у больного: отделяемое карбункула, мокроту, испражнения, кровь, материал от животных (шерсть, кожа, мясо, трупный материал и др.), воду, почву, смывы с различных объектов внешней среды. Лабораторная диагностика сибирской язвы складывается из микробиологического исследования, биопробы, кожно-аллергической пробы, реакции термопреципитации по Асколи.
При микробиологическом исследовании готовят мазок из патологического материала, окрашивают по Граму, микроскопируют. Затем материал засевают на мясо-пептонный агар и мясо-пептонный бульон и выращивают сутки в термостате при 37°С. Выделенную культуру идентифицируют по морфологическим и культуральным свойствам. Для выделения чистой культуры сибиреязвенных бацилл, исследуемый материал можно вводить подкожно морским свинкам или белым мышам (биопроба). Животные погибают обычно через 1—2 дня. Характерная патологоанатомическая картина при вскрытии и микроскопия мазков из различных органов (наличие капсульных сибиреязвенных бацилл) помогают поставить диагноз.
 3.50 Препарат «Слизистые колонии на питательной среде».
3.50 Препарат «Слизистые колонии на питательной среде».
1)Бак. метод, получение изолированных колоний на плотной питательной среде; слизистые колонии капсулообразующих бактерий; микроскопия при окраске по Бури-Гинсу, б/х идентификация; капсула и слизистый слой обуславливают адгезивные и протективные св-ва бактерий, капсульные АГ. Посев материала также делают бактериальной петлей. Для этого в верхней части чашки густо заштриховывают зигзагообразными движениями петли небольшой участок агаровой среды, освободив таким образом петлю от излишнего материала. Затем наносят параллельные штрихи по остальной части среды. Иногда применяют метод пластинчатых разводок, который заключается в перемешивании различных разведении исследуемого материала с расплавленным и остуженным питательным агаром в колбе или пробирке. После этого его разливают в чашки Петри и инкубируют в термостате. Для уничтожения сопутствующих неспорообразующих микроорганизмов исследуемый материал прогревают при 80°С или подвергают кратковременному кипячению. Споры микроорганизма при этом охраняются и при посеве прогретого материала на питательную еду прорастают, образуя чистую бактериальную культуру в Ш случае, если принадлежат только данному виду. Если в исследуемом материале содержатся споры разных видов бактерий, то данный метод для получения чистой культуры непри-оден.Подавление размножения посторонней микрофлоры при еве исследуемого материала на питательные среды достается воздействием на них каких-либо факторов, не препят-рпвующих размножению основного микроба: неодинаковой ьной температуры для роста разных бактерий, анти-этиковили других химических веществ, а такжефагов, первом случае посевы инкубируют при температуре, задер-вающей рост сопутствующей микрофлоры. Так, например, выделения чистой культуры бактерий чумы посевы инку-руют при температуре около 5°С. Во втором случае в пита-ьную среду вносят соответствующее вещество или фаг в рого определенной концентрации, препятствующей размно-внию сопутствующих бактерий, но не оказывающей выраженного ингибирующего действия на исследуемый микроб. Кроме упомянутых методов, в бактериологической практике адгда применяются и другие, например для выделения чистой ультуры бактерий протея (Рго1еш ушеапз) используют его юсобность к «ползучему» росту.Для выделения чистых культурбольшинства бактерий обычно затрачивается не более 2—3сут. Для выращивания микобактерий туберкулеза этот срок удлиняется до 4-6 нед. Процесс выделения чистой культуры можно разделить на Несколько этапов.Первый этап. Из исследуемого материала готовят мазок, окрашивают по Граму или другим методом и микроскопируют. Для посева исследуемый материал в случае необходимости разводят в пробирке со стерильным изотоническим раствором хлорида натрия. Одну каплю приготовленного разведения наносят петлей на поверхность питательного агара в чашку Петри и тщательно втирают шпателем в среду, равномерно распределяя материал по всей ее поверхности. После посева чашку переворачивают дном кверху, подписывают и помещают в термостат при 37°С на 18—24 ч.. рВторой этап. Просматривают чашки и изучают изолированные колонии, обращают внимание на их форму, величину, консистенцию и другие признаки. Для определения морфологии клеток и их тинкториальных свойств из части исследуемой колонии готовят мазок, окрашивают по Граму и микроскопируют. Для выделения и накопления чистой культуры одну изолированную колонию или несколько различных изолированных колоний пересевают в отдельные пробирки со скошенным агаром или какой-либо другой питательной средой. Для этого часть колонии снимают петлей, не задевая соседние колонии.Третий этап. Отмечают характер роста выделенной чистой культуры. Визуально чистая культура характеризуется однородным ростом. При микроскопическом исследовании окрашенного мазка, приготовленного из такой культуры, в нем обнаруживаются морфологически и тинкториально однородные клетки. Однако в случае выраженного полиморфизма, присущего некоторым видам бактерий, в мазках из чистой культуры наряду с типичными встречаются и другие формы клеток.
 3.51 Препарат «Лактозопозитивные колонии на среде Эндо».
3.51 Препарат «Лактозопозитивные колонии на среде Эндо».
1,2)Бак. метод, получение изолированных колоний на плотной диф.-диагн. среде с лактозой; 3)лак+ колонии,так как микробы ферментируют лактозу и окрашиваются в цвет индикатора; 4)серолог. идентификация с О-специфическими агглютинирующими сыв-ками; 5)трансдукция – перенос ген. инф-ции от клетки донора в клетку реципиента с помощью умеренного фага.
 3.52 Препарат «Лактозо- позитивные и –негативные колонии на среде Левина».
3.52 Препарат «Лактозо- позитивные и –негативные колонии на среде Левина».
1)Бак. метод, получение изолированных колоний на плотной диф.-диагн. среде с лактозой;3)в зависимости от индикатора срелы лак+ окрашиваются в определенный цвет,а лак- почти не окр.,что позволлдяет дифференцировать колонии кишечной палочки от других: лак+ колонии и лак-; 4)серолог. идентификация с О-специфическими агглютинирующими сыв-ками;5) энтеропатогенные, -инвазивные, -токсигенные и т. п., по структуре О-АГ.
 3.53 Препарат «Лактозопозитивные и лактозонегативные колонии на дифференциально-диагностической среде ».
3.53 Препарат «Лактозопозитивные и лактозонегативные колонии на дифференциально-диагностической среде ».
1)Бак. метод, получение изолированных колоний на плотной диф.-диагн. среде с лактозой; лак+ колонии; серолог. идентификация с О-специфическими агглютинирующими сыв-ками; энтеропатогенные, -инвазивные, -токсигенные и т. п., по структуре О-АГ.5)посев на одну из дифф-диагн. Сред с лактозой, и лас-колонии пересевают на среду Рессля,проводится б\х и сер идентифик. К О,К и Н агглютинирующими спец. Сыворотками,также необходимо сделать посев на щелочной агар или TCBS для исключения наличия в материале холерного вибриона.
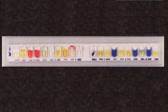 3.54 Препарат «Тест-системе API E».
3.54 Препарат «Тест-системе API E».
Бак. метод, идентификация по б/х св-вам в API Entero: культура ферментирует глюкозу,
но не лактозу, даёт положительную пробу на индол, но не на сероводород,
следовательно, относится к роду шигелл; серолог. идентификация на стекле с моно- и
полирецепторными сыв-ками; биовары и серотипы. Шигеллы имеют вид палочек без жгутиков, с закругленными концами размером 2–3 на 0,5–0,7 мкм. Не образуют спор и капсул. Шигеллы плохоустойчивы к воздействию физических, химических и биологических факторов окружающей среды. В воде, почве, пищевых продуктах, на предметах, посуде, овощах, фруктах шигеллы живут в течение 5–14 дней. При температуре 60 °С шигеллы гибнут через 10–20 минут, при 100 °С — мгновенно. Прямой солнечный свет убивают шигелл в течение 30 минут. При отсутствии солнечного света, повышенной влажности и умеренной температуре шигеллы сохраняют жизнеспособность в почве до 3 месяцев. В желудочном соке шигеллы могут выживать лишь несколько минут. В пробах кала шигеллы погибают от действия кислой реакции среды и бактерий-антагонистов через 6–10 часов. В высушенном или замороженном кале шигеллы жизнеспособны в течение нескольких месяцев. Наиболее устойчивым к внешним воздействиям является вид шигелл Shigella sonnei, наименее устойчивым — Shigella dysenteriae. Шигеллы названы в честь японского врача и микробиолога Киёси Шига (или Сига; 1871–1951), выделившего в 1897 году в чистом виде бактерии, относящиеся сегодня к виду Shigella dysenteriae. Шигеллы дизентерии (лат. Shigella dysenteriae) — один из четырех видов рода шигеллы (Shigella), который входит в семейство энтеробактерии (лат. Enterobacteriaceae), порядок энтеробактерии (лат. Enterobacteriales), класс гамма-протеобактерии (лат. γ proteobacteria), тип протеобактерии (лат. Proteobacteria), царство бактерии.
Считается, что виды шигелл совпадают с соответствующими серогруппами. Все виды шигелл (а это, кроме шигелл дизентерии, также шигеллы Бойда, шигеллы Флекснера и шигеллы Зонне) являются возбудителями дизентерии. В виде шигеллы дизентерии выделено 12 серотипов.
Ранее применялись следующие наименования различных серотипов:
шигеллы дизентерии Sh. dysenteriae серотип 1 — палочки Григорьева – Шиги
шигеллы дизентерии Sh. dysenteriae серотип 2 — палочки Штуцера – Шмитца
шигеллы дизентерии Sh. dysenteriae серотипы 3–7 — палочки Ларджа – Сакса