Великий Новгород 2010 год
АГРЕГАТ СИНТЕЗА АММИАКА
Физико-химические основы синтеза аммиака
Реакция синтеза аммиака из газообразных азота и водорода является обратимой и протекает по уравнению
3H2+N2=2NH3+22 ккал.
При определенных условиях наступает состояние равновесия между прямым и обратным процессами, при котором невозможно дальнейшее увеличение содержания аммиака в газовой смеси. На практике стараются создать такие условия, при которых равновесие реакции сдвигается в сторону образования аммиака из азота и водорода.
Так как реакция синтеза аммиака сопровождается уменьшением объема газовой смеси вдвое, то для сдвига равновесия вправо, согласно принципу Ле Шателье, процесс следует проводить при повышенном давлении. В промышленности установки по производству синтетического аммиака работают под давлением 300—900 ат.
Реакция синтеза протекает с выделением тепла. Поэтому согласно принципу Ле Шателье, с повышением температуры равновесие реакции сдвигается влево, т. е. чем выше температура, тем меньше азота и водорода вступают в реакцию. При низкой температуре реакция синтеза аммиака протекает более полно.
Однако с понижением температуры скорость большинства химических реакций, в том числе и скорость реакции синтеза аммиака, уменьшается. Поэтому для обеспечения значительной скорости образования аммиака реакцию необходимо проводить при достаточно высокой температуре. Практически синтез аммиака ведется при температуре 450— 500° С, при которой реакция протекает достаточно быстро и содержание аммиака в газовой смеси сравнительно высоко.
По закону действия масс для сдвига равновесия реакции синтеза аммиака вправо необходимо в равновесной газовой смеси увеличить концентрацию азота и водорода или уменьшить концентрацию аммиака. Последнее осуществляется на практике. После того, как из азота и водорода образовалось некоторое количество аммиака, газовую смесь выводят из колонны синтеза и освобождают ее целиком или частично от аммиака. Затем к газовой смеси добавляют свежие азот и водород и вновь пропускают ее через колонну синтеза. Повторяя этот процесс непрерывно, добиваются почти полного использования азотоводородной смеси.
Образовавшийся аммиак выделяется из газовой смеси путем конденсации его. Превращение газообразного аммиака в жидкость, т. е. процесс конденсации, осуществляется охлаждением газовой смеси водой и испаряющимся аммиаком. В системах синтеза аммиака, работающих при давлениях 300 ат и ниже, охлаждение газовой смеси производится в две стадии: водой в скоростных холодильниках и испаряющимся жидким аммиаком - в аммиачных испарителях.
Содержание аммиака в газовой смеси на выходе из колонны синтеза зависит еще и от объемной скорости. Чем больше последняя, тем меньше времени газовая смесь находится в колонне синтеза аммиака, заполненной катализатором. С увеличением объемной скорости содержание аммиака в газовой смеси уменьшается.
Для каждого давления существует своя оптимальная объемная скорость газа, обеспечивающая максимальное использование катализатора и максимальную производительность всех аппаратов, входящих в систему синтеза аммиака.
В зависимости от величины давления азотоводородной смеси системы синтеза аммиака делятся на три типа:
1. Системы, работающие при низких давлениях (90— 100 ат).
2. Системы, работающие при средних давлениях (200— 350 ат).
3. Системы, работающие при высоких давлениях (500— 1000 ат).
Широкое распространение в Советском Союзе и за границей получили системы синтеза аммиака, работающие при средних давлениях. Системы низкого давления в виду их сложности в промышленности применяются мало.
Катализатор синтеза аммиака должен быть активным при определенных условиях в течение длительного времени и стойким к ядам.
Каталитическими свойствами по отношению к реакции синтеза аммиака обладают многие металлы. Наибольшее промышленное применение получили железные катализаторы, являющиеся по сравнению с другими особенно активными и дешевыми в изготовлении.
Железо приобретает каталитическую активность лишь в том случае, если оно приготовлено восстановлением окислов железа при определенных условиях.
Не вся масса катализатора обладает активными свойствами, а лишь отдельные его участки, называемые активными центрами. Чем меньше частицы катализатора, тем более развита его поверхность, тем активнее катализатор.
К железному катализатору добавляют окись алюминия Аl2О3и окись калия К2О, которые являются активаторами катализаторов. Активаторы не ускоряют реакцию синтеза аммиака, а улучшают физическую структуру катализатора, повышают его устойчивость, увеличивают число активных центров. Окись алюминия обволакивает кристаллы железа тонкой пленкой, которая мешает взаимодействию атомов железа и росту кристаллов. Однако окись алюминия обладает свойством адсорбировать, т. е. удерживать на своей поверхности образовавшийся аммиак, что является крайне нежелательным. Для подавления адсорбционной активности окиси алюминия в катализатор вводят второй активатор К2О.
В дважды промотированных (содержащих два активатора) катализаторах отношение количеств Аl2О3иК2О должно быть близким к 2: 1.
Сырьем для получения катализаторов являются железо и магнитная железная руда. Процесс приготовления катализатора состоит из двух стадий: получения окислов железа и восстановления их водородом до металлического железа.
Технический процесс получения катализатора синтеза аммиака из железной руды осуществляется следующим образом: концентрат подвергают трехкратной сепарации, восстановлению в печи с помощью водорода и электроплавке в индукционных печах, затем плав окисляют, охлаждают и дробят. Готовый катализатор сортируют.
С июня 1967 г. введен первый ГОСТ на катализатор синтеза аммиака СА-1 (ГОСТ 12411—66). В соответствии с указанным ГОСТ лимитируется содержание промотирующих и примесных компонентов. Содержание окиси алюминия в катализаторе должно быть в пределах 3 — 4%. При содержании в катализаторе 2% Аl2О3резко уменьшается его устойчивость, а при содержании 6% Аl2O3, значительно снижается активность катализатора. Оптимальное содержание К20 0,7—1%.
В катализаторе допускается наличие SiO2— до 0,7% (примесь сырья) и МgО — до 0,7% (примесь, попадающая при проведении плавки в магнезитовых тиглях). Содержание вредных примесей (Си, Ni, S) должно быть минимальным.
С целью повышения механической прочности катализатора ГОСТ предусматривает уменьшение степени окисления катализаторного плава (FеО —29—36%) и выпуск гранулированного катализатора с размером зерен (гранул) -не менее 3 мм.
Вторая стадия приготовления катализатора — восстановление окислов железа до элементарного железа водородом — в большинстве случаев проводится в колоннах синтеза аммиака.
Процесс восстановления катализатора протекает по уравнениям:
FеО + Н2= Fе + Н2О;
Fе2О3+ ЗН2 =2Fе + ЗН2О
Fе304 + 4H2=ЗРе + 4Н20.
Водяные пары конденсируются в конденсаторах и отделяются от газовой смеси в сепараторах и в конденсационной колонне. Реакции восстановления окислов железа эндотермичны и протекают лишь при нагревании, которое осуществляется с помощью электроподогревателя.
Восстановление окислов железа проводят при постепенном повышении температуры и давления. Объемная скорость водорода при восстановлении катализатора должна быть не ниже 10 000 м3 на 1 м3катализатора в час. Режим восстановления катализатора контролируется по часовому количеству воды, выделяющейся в сепараторах. Процесс восстановления катализатора в колонне синтеза аммиака протекает в течение 5—6 суток.
О готовности катализатора судят по количеству выделившейся реакционной воды и по содержанию аммиака в ней. Общее количество выделившейся аммиачной воды при полном восстановлении 1 м3 катализатора должно составлять 0,6—0,8 м3. Содержание аммиака в воде 80— 90% вес.
В последнее время разработана методика восстановления катализатора синтеза аммиака непосредственно в цехах приготовления катализаторов. Процесс восстановления осуществляется под давлением 10—15 ат при объемной скорости водорода 2000—3000 м3 на 1 м3 катализатора в час. Восстановление катализатора длится в течение 4 суток с повышением температуры от 380 до 500° С (через каждые 12 ч —на 25°). После восстановления катализатор азотируют и пассивируют при температуре 200° С, а затем производят его поверхностное окисление при содержании в газе 0,2% кислорода.
В процессе работы катализатор может отравляться катализаторными ядами, в результате чего его активность снижается или полностью исчезает.
Отравление катализатора, как известно, бывает временным и постоянным. Такие вещества, как кислород, окись углерода, углекислый газ и пары воды вызывают временное отравление катализатора. Последний под действием этих веществ теряет свою активность и вновь восстанавливает ее при пропускании чистой азотоводородной смеси, не содержащей указанных веществ. Постоянное отравление катализатора является необратимым. Оно наступает при действии мышьяка, фосфора и соединений серы. Восстановить активность катализатора при отравлении его этими веществами путем пропускания чистой азотоводородной смеси не удается.
При попадании на катализатор паров воды металлическое железо окисляется и теряет свою активность. Процесс отравления катализатора водяными парами протекает по уравнениям:
Fе + Н2О =FеО + Н2;
2Fе + ЗН2О = Fе2О3+ ЗН2.
При пропускании через катализатор азотоводородной смеси, не содержащей паров воды, идет обратный процесс восстановления окислов. Содержащиеся в азотоводородной смеси окислы углерода реагируют с водородом по уравнениям
СО +ЗН2=СН4 +Н2О
CO2+4H2=СН4+ 2Н20.
Образующиеся водяные пары взаимодействуют затем с железом катализатора. Содержание окиси углерода в азотоводородной смеси не должно превышать 0,002%, двуокиси углерода — 0,0001%.
Отрицательное действие на активность катализатора оказывают также масла, уносимые свежей азотоводородной смесью из компрессоров высокого давления и циркуляционным газом — из поршневых циркуляционных насосов. Поэтому газ после сжатия в поршневых машинах должен подвергаться тщательной очистке от капелек масла.
Срок непрерывной работы колонны синтеза зависит от ряда факторов: степени очистки азотоводородной смеси от катализаторных ядов, режима восстановления катализатора и состояния насадки колонны. Замена катализатора производится один раз в два года. Однако в практике нередки случаи, когда срок непрерывной работы колонны превышает три года.
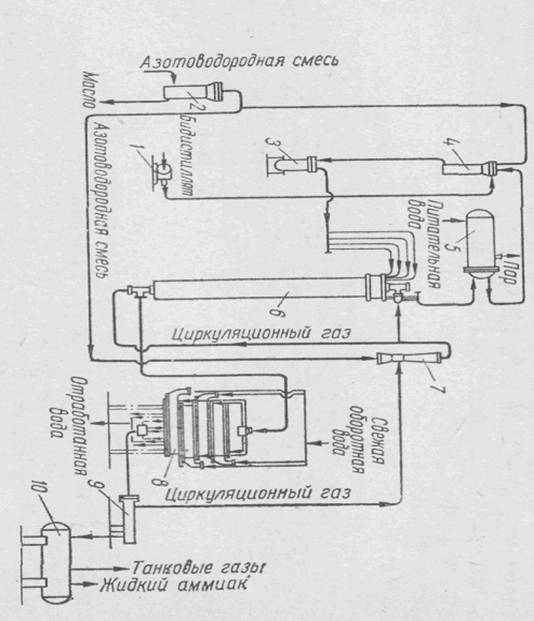
Рис 1. Схема агрегата высокого давления
На рисунке представлена схема агрегата синтеза аммиака под давлением 500 ат с использованием тепла, выделяющегося в результате реакции, для получения водяного пара.
Азотоводородная смесь под давлением 520 ат поступает в фильтр 2, где очищается от масла, и направляется в инжектор 7. Циркуляционный газ подсасывается в инжектор струей свежего газа. Газовая смесь подается в колонну синтеза 6, состоящую из катализаторной коробки с теплоотводящими устройствами, теплообменника и электроподогревателя. Из колонны газ, содержащий около 18—21% аммиака, при температуре 100—120° С поступает в водяной конденсатор 8, где охлаждается до 35° С. При этом конденсируется весь аммиак. Из конденсатора 8 газ направляется в сепаратор 9, где отделяется жидкий аммиак, поступающий затем в сборник 10. Циркуляционный газ после сепаратора возвращается во всасывающую линию инжектора 7. Тепло, выделяющееся в результате реакции синтеза, используется для получения пара по двухконтурной схеме, аналогичной описанной выше. Пар получается в котле-утилизаторе 5. Циркуляция бидистиллята осуществляется насосом 3, давление в контуре поддерживается с помощью уравнительного сосуда 4. Уровень бидистиллята в котле-утилизаторе поддерживается дозировочным насосом 1.
Расчет ведем на 1000 м3свежей смеси, с которой поступает (в кмоль):
H2 746/22,4 =33,30
N2 249/22,4=11,116
CH4 5/22,4=0,223
-------------------------------------
Итого 44,639
а) Количество и состав продувочных газов. Количество продувочных газов определяется.
Х = 100*0,223/5= 4,460 кмоль на 1000 м3 свежей смеси.
Содержание NН3в них при Р = 80 Мн/м2 и t=16°С равно 4%. Следовательно, состав продувочных газов: 5% СН4, 4% NН3и 91% (ЗН2+ N2). Отсюда на 1000 м3 смеси продувается газа, т. е. выходит из цикла (в кмоль):
СН4 5*4,460/100=0,223
NH3 4*4,460/100=0,178
Смеси N2 и H2 91*4,460/100=4,059
-------------------------------------
Итого... 4,460
б) Количество циркуляционной смеси в цикле (у кмоль) и количество газа, выходящего из колонны синтеза, (z кмоль) на 1000 м3 (44,639 кмоль) свежей смеси.
Пусть d кмоль — количество аммиака,выводимого через сепаратор.
Тогда z=(y+d+4,460) кмоль
С другой стороны, количество газовой смеси (г кмоль) составится из суммы циркулирующей смеси в цикле (у кмоль) и свежей азото-водородной смеси (44,639 кмоль) минус уменьшение объема газа в процессе синтеза. Согласно уравнению реакции синтеза аммиака (ЗН2 +N2 =2NH3), из 2 кмоль азото-зодородной смеси образуется 1 кмоль МН3. Следовательно, если обозначить через е количество кмоль N Н3, образовавшегося в колонне синтеза, то и объем газовой смеси после реакции уменьшится на е кмоль.
Отсюда имеем
z = (y + 44,639 — е) кмоль.
Приравнивая 2 уравнения друг к другу, получим:
d = (40,179— е) кмоль.
Синтез протекает таким образом, что количество аммиака, образующегося в колонне (е кмоль), должно быть равно количеству его, выводимому из цикла через сепаратор (d кмоль) и с продувочными газами (0,178 кмоль). Следовательно,
е = ( d+0, 178) кмоль.
Совместное решение уравнений дает:
e=20.179 d=20.001
Количество газовой смеси на выходе из колонны (z кмоль) и количество циркулирующей смеси (у кмоль) определится из следующего. В газовой смеси содержится 25% NН3 и в циркулирующем газе (так же, как и в продувочном) 4% NНз. Все количество NНз, содержащееся в газовой смеси (25%), распределяется в дальнейшем ходе процесса так:
выводится из цикла через сепаратор в виде жидкого NН3(аммиака-продукта) 20,001 кмоль;
выводится из цикла с продувочными газами 0,178 кмоль;
уходит с циркулирующей смесью b кмоль.
Отсюда общее количество NНз определится
NН3 = 20,001 +0,178 +b-= (20,179 +b) кмоль.
Это количество NНз должно составить 25% по отношению ко всей смеси (г кмоль).
Отсюда:
z=(20.179+b)/0.25=(80.716+4*b) кмоль
С другой стороны, содержание NНз в циркулирующей смеси 4%, а всего смеси получается
у кмоль. Отсюда:
y=b/0.04=25*b кмоль.
Вычитая одно равенство из другого, получим:
z-y=(80/716-21*b) кмоль
z-y=(44.639-e)=24.460 кмоль
b=56.256/21=2.679 кмоль
Таким образом, в циркулирующей смеси постоянно находится 2,679 кмоль N Н3. Количество этой смеси:
у = 25*2,679 = 66,975 кмоль, а количество газовой смеси после колонны синтезаz= 80.716 + 4*2,679 = 91,432 кмоль.
В циркулирующей смесь входит 5 % CH4
66.975*0.05=3.337 кмоль