Лабораторная работа №16
Реактивы:
1. о-хлорбензойная кислота 15,2 г (0,09687 моль)
2. Нитрат калия 10,9 г (0,108 моль)
3. Серная кислота (98%, р 1,84г/см3) 73 г (0,745 моль)
Лабораторная посуда и оборудование:
1. Фарфоровый стакан или трехгорлая колба
2. Термометр
3. Мешалка
4. Воронка Бюхнера
5. Колба Бунзена
Уравнения реакций:
А) Основной:
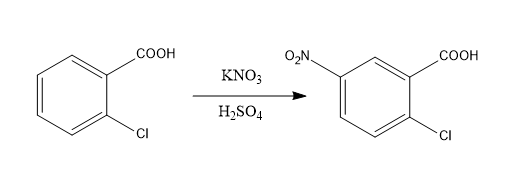
Б) Побочной:
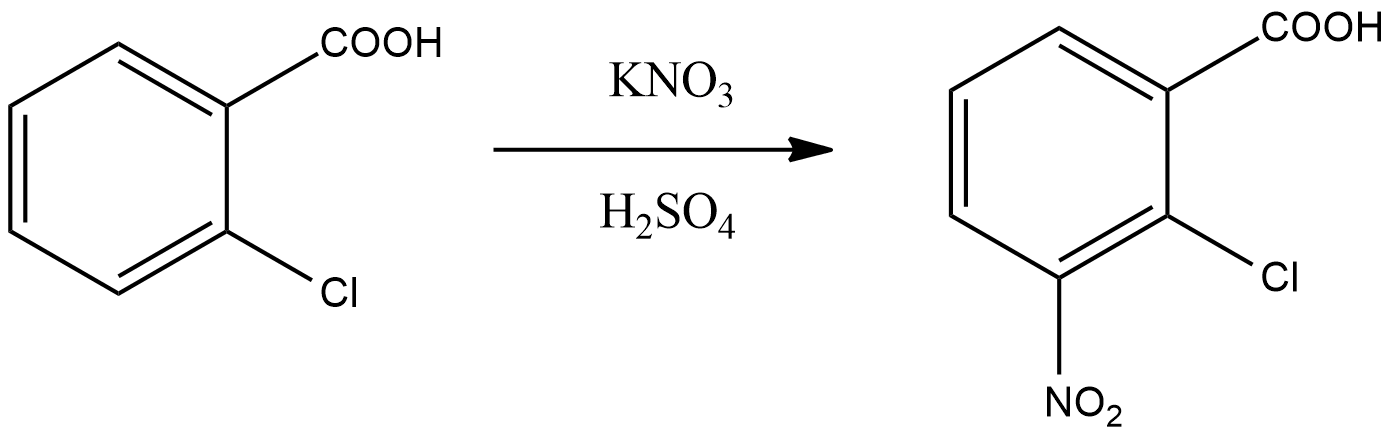
Классификация по механизму:
Реакция нитрования протекает как электрофильное замещение в ароматическом кольце  . Карбоксильная группа – сильный электроноакцепторный ориентант второго рода, затрудняющий реакции электрофильного замещения, поэтому нитрование бензойных кислот проводят при нагревании в жестких условиях: дымящей азотной кислотой или нитратами щелочных металлов в конц. серной кислоте.
. Карбоксильная группа – сильный электроноакцепторный ориентант второго рода, затрудняющий реакции электрофильного замещения, поэтому нитрование бензойных кислот проводят при нагревании в жестких условиях: дымящей азотной кислотой или нитратами щелочных металлов в конц. серной кислоте.
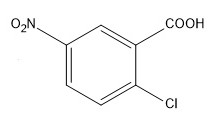
В о-хлобензойной кислоте заместители имеют согласованную ориентацию, направляя электрофил преимущественно в положение 5.
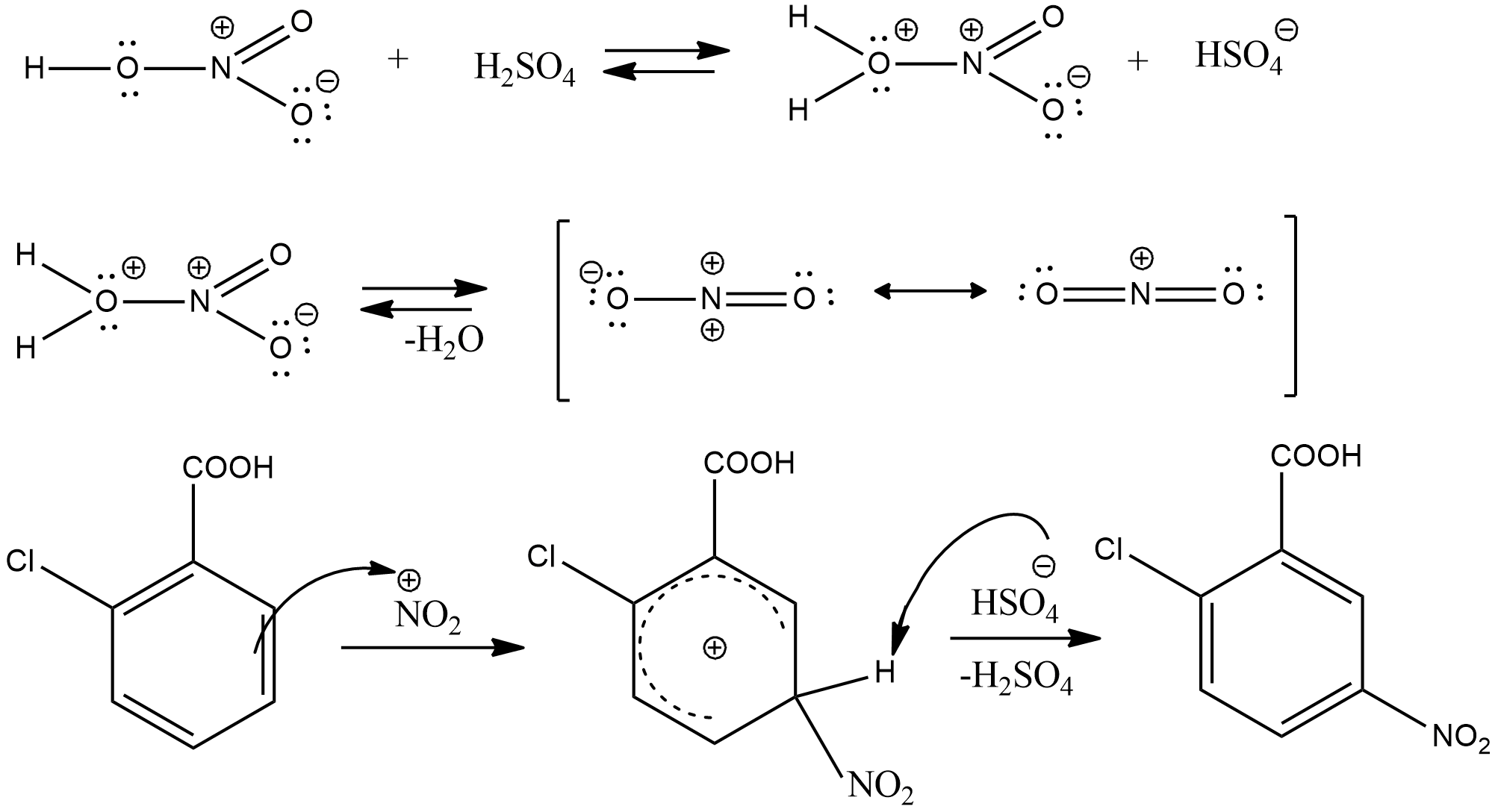
Схема установки:
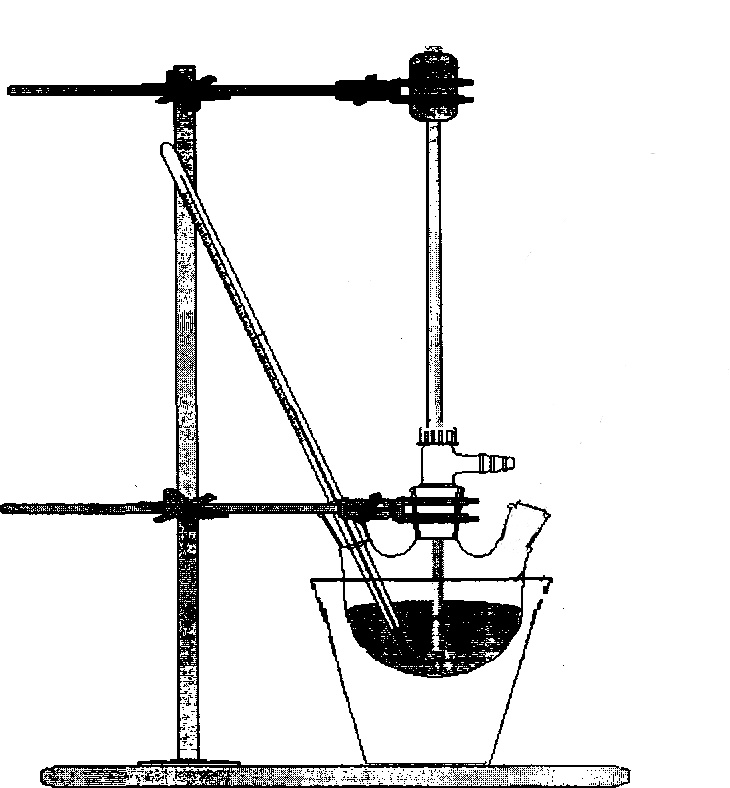
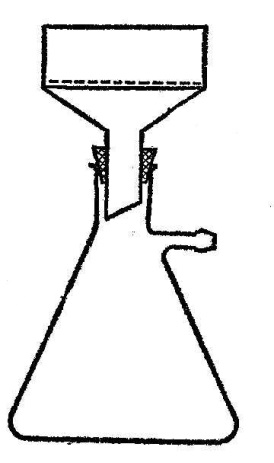
| Ход работы | Наблюдения |
| 1. В фарфоровый стакан высыпаю 15,2 г о-хлорбензойной кислоты и добавляю серную кислоту при постоянном перемешивании. Опускаю стакан в лед и постепенно прибавляю нитрат калия, следя, чтобы температура смеси не поднималась выше 30℃. Перемешиваю в течение 15 минут. 2. После полного растворения нагреваю стакан с содержимым до 60℃ при перемешивании и выдерживаю при этой температуре 20 минут. 3. Выливаю в стакан ледяную воду и отфильтровываю на воронке Бюхнера и колбе Бунзена. 4. Растворяю порошок в 5% растворе NaOH при нагревании. 5. После полного растворения и остывания вливаю в колбу разбавленную (≈10%) азотную кислоту 6. Фильтрую содержимое колбы на воронке Бюхнера и колбе Бунзена. 7. Высушиваю отфильтрованный порошок и взвешиваю | Смесь загустевает и становится вязкой. Придобавлении нитрата калия температура начинает подниматься – идет реакция:
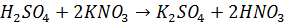 Смесь становится менее густой, имеет серовато-белый цвет
Жидкость в стакане белого цвета, в воронке остается белый порошок
Жидкость в колбе имеет желтоватый цвет
В колбе мгновенно образуется белая густая взвесь
На фильтре остается более чистый белый порошок
Масса продукта 14,8 г
Выход около 76%
Смесь становится менее густой, имеет серовато-белый цвет
Жидкость в стакане белого цвета, в воронке остается белый порошок
Жидкость в колбе имеет желтоватый цвет
В колбе мгновенно образуется белая густая взвесь
На фильтре остается более чистый белый порошок
Масса продукта 14,8 г
Выход около 76%
|
| Количество исходных веществ | Избыток моль | – | 0,01113 | – | |
| По уравнению моль | 0,09687 | 0,09687 | – | ||
| По методике | моль | 0,09687 | 0,108 | 0,745 | |
| Масса 100% концентрации г | 15,2 | 10,9 | 71,54 | ||
| Масса данной концентрации г | 15,2 | 10,9 | |||
| Объем Мл | 39,7 | ||||
| Характеристика исходных веществ | Константы для к-т и щелочей | Плотность г/см3 | 2,109 | 1,84 | |
| Концентрация % | |||||
Т.Пл. ˚С
Т.Кип. ˚С
Плотность г/см3
| 141-142 – | ||||
| Физиологические свойства | Раздражающее действие | Малотоксичен | Едкое токсичное ожог | ||
| Молекулярная масса г/моль | 156.5 | ||||
| Название реактива и формула | о-хлорбензойная кислота
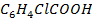
| Нитрат калия
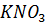
| Серная кислота H2SO4 |
| Отделение от побочных продуктов | О-нитрофенол отгоняется с паром в отличие от п-нитрофенола | |||
| Кислотно-основные свойства | Кислотные свойства выражены сильнее, бензойной кислоты | Кислотные свойства выражены сильнее, чем у бензойной кислоты | ||
| Растворимость в воде | Малорастворим | Малорастворим | ||
| Константы из справочника | 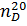
| – | – | |
| Плотность г/см3 | – | – | ||
| Т.Кип. ˚С | – | – | ||
| Т.Пл. ˚С | 164-5 | 153-7 | ||
| Физиологические свойства | Раздражающее действие | Раздражающее действие | ||
| Молекулярная масса г/моль | 201,5 | 201,5 | ||
| Название вещества и формула | 5-нитро-2-хлорбензойная кислота
| 3-нитро-2-хлорбензойная кислота

|
Выход:
| Название и формула | Константы | Масса продукта г | Выход % | Теоретический выход | |
Т.пл.
Т.кип.
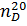
| От теоретического | От указанного в руководстве | |||
| 5-нитро-2-хлорбензойная кислота | 164–166 | 14,8 | 0,76 | 201,5*0,09687моль=19,52 |
Вывод:
В ходе лабораторной работы из о-хлорбензойной кислоты, нитрата калия и серной кислоты была получена и очищена с помощью переосаждения 5-нитро-2-хлорбензойная кислота с выходом 76%.