Происхождение названия
В 1669 году Хеннинг Бранд при нагревании смеси белого песка и выпаренной мочи получил светящееся в темноте вещество, названное сначала «холодным огнём». Вторичное название «фосфор» происходит от греческих слов «φῶς» — свет и «φέρω» — несу. В древнегреческой мифологии имя Фосфор (или Эосфор, др.-греч. Φωσφόρος) носил страж Утренней звезды.
Получение
Фосфор получают из апатитов или фосфоритов в результате взаимодействия с коксом и кремнезёмом при температуре 1600 °С:
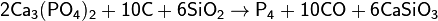
Образующиеся пары фосфора конденсируются в приёмнике под водой в аллотропическую модификацию в виде белого фосфора. Вместо фосфоритов восстановлению можно подвергнуть и другие соединения, например, метафосфорную кислоту:
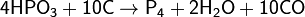
Применение
Фосфор является важнейшим биогенным элементом и в то же время находит очень широкое применение в промышленности. Красный фосфор применяют в производстве спичек. Его вместе с тонко измельчённым стеклом и клеем наносят на боковую поверхность коробки. При трении спичечной головки, в состав которой входят хлорат калия и сера, происходит воспламенение.
| Хлорид фосфора(V) | |
| |
| Общие | |
| Систематическое наименование | Хлорид фосфора(V) |
| Химическая формула | PCl5 |
| Физические свойства | |
| Состояние (ст. усл.) | белый порошок |
| Отн. молек. масса | 208.22 а. е. м. |
| Молярная масса | 208.22 г/моль |
| Плотность | 1.6 г/см³ |
| Термические свойства | |
| Температура плавления | 160 °C |
| Температура кипения | возгоняется при 159 °C |
| Химические свойства | |
| Растворимостьв воде | Реагирует |
| Классификация | |
| Рег. номер CAS | 10026-13-8 |
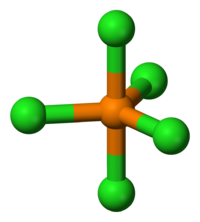
Хлорид фосфора(V)
Пентахлор́ид фо́сфора (хлорид фосфора(V), хлорангидрид фо́сфорной кислоты, пятихлористый фосфор) — соединение фосфора и хлора с формулой PCl5.
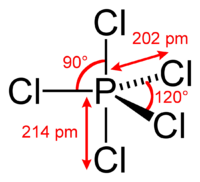
Молекула PCl5 в газообразном или жидком состояниях имеет конфигурацию тригональной бипирамиды с атомом фосфора в основании. Твёрдый пентахлорид фосфора состоит из тетраэдрических ионов [PCl4]+ и октаэдрических ионов [РCl6]− (d P—Cl в тетраэдре 0,197 нм, в октаэдре 0,204 нм (экваториальные) и 0,208
Свойства
При нагревании выше 300 °C, полностью разлагается на PCl3 и Cl2.
Пентахлорид фосфора типичное кислотное соединение. Он энергично реагирует с водой, образуя по первой стадии оксохлорид фосфора (V):
PCl5 + H2O → POCl3 + 2 HCl
В горячей воде гидролиз протекает полностью, до образования ортофосфорной кислоты:
PCl5 + 4 H2O → H3PO4 + 5 HCl
Для РCl5 характерны реакции окислительного хлорирования:
PCl5 + 2 NO2 → PCl3 + 2NO2Cl
C концентрированой серной кислотой образует хлорсульфоновую кислоту:
PCl5 + H2SO4 → ClSO2OH + POCl3 + HCl
При нагревании РCl5 и NH4Cl происходит реакция образования полимера фосфонитрилхлорида:
nPCl5 + nNH4Cl → (PNCl2)n + 4nHCl
(PNCl2)n — прозрачное эластичное вещество, «неорганический каучук». Выдерживает нагревание выше 200 °C. К сожалению, фосфонитрилхлорид сравнительно легко гидролизуется, что затрудняет его практическое использование. Заменой атомов Cl на органические радикалы можно получить водоустойчивые полимеры.
Получение
Получают действием избытка хлора на хлорид фосфора(III):
PCl3 + Cl2 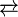 PCl5 ΔH = −124 кДж/моль
PCl5 ΔH = −124 кДж/моль
Применение
PCl5 — сильный хлорирующий агент, его используют при получении хлорангидридов фосфорных и фосфоновых кислот из олефинов, в производстве лекарственных средств и красителей.
Токсичность
Токсичен, ПДК 0,2 мг/м3.
Физические свойства
Элементарный фосфор в обычных условиях представляет собой несколько устойчивых аллотропических модификаций; вопросаллотропии фосфора сложен и до конца не решён. Обычно выделяют четыре модификации простого вещества — белый, красный, чёрный и металлический фосфор. Иногда их ещё называют главными аллотропными модификациями, подразумевая при этом, что все остальные являются разновидностью указанных четырёх. В обычных условиях существует только три аллотропических модификации фосфора, а в условиях сверхвысоких давлений — также металлическая форма. Все модификации различаются по цвету, плотности и другим физическим характеристикам; заметна тенденция к резкому убываниюхимической активности при переходе от белого к металлическому фосфору и нарастанию металлических свойств.
| Кристаллическая решётка простого вещества | |
| Структура решётки | кубическая, объёмноцентрированная |
| Параметры решётки | 18,800 Å |
| Прочие характеристики | |
| Теплопроводность | (300 K) (0,236) Вт/(м·К) |

Химические свойства
Химическая активность фосфора значительно выше, чем у азота. Химические свойства фосфора во многом определяются его аллотропной модификацией. Белый фосфор очень активен, в процессе перехода к красному и чёрному фосфору химическая активность резко снижается. Белый фосфор на воздухе светится в темноте, свечение обусловлено окислением паров фосфора до низших оксидов.
В жидком и растворенном состоянии, а также в парах до 800 °С фосфор состоит из молекул Р4. При нагревании выше 800 °С молекулы диссоциируют: Р4 = 2Р2. При температуре выше 2000 °С молекулы распадаются на атомы.
Биологическая роль соединений фосфора
Фосфор присутствует в живых клетках в виде орто- и пирофосфорной кислот, входит в состав нуклеотидов, нуклеиновых кислот, фосфопротеидов, фосфолипидов, коферментов, ферментов. Кости человека состоят из гидроксилапатита 3Са3(РО4)3·Ca(OH)2. В состав зубной эмали входит фторапатит. Основную роль в превращениях соединений фосфора в организме человека и животных играет печень. Обмен фосфорных соединений регулируется гормонами и витамином D. Суточная потребность человека в фосфоре 800—1500 мг. При недостатке фосфора в организме развиваются различные заболевания костей.
| ||||
| Внешний вид простого вещества |
 Белый, красный, жёлтый, черный фосфор Белый, красный, жёлтый, черный фосфор
| |
| Свойства атома | |
| Имя, символ, номер | Фосфор/ Phosphorus (P), 15 |
| Атомная масса (молярная масса) | 30,973762 а. е. м. (г/моль) |
| Электронная конфигурация | [Ne] 3s2 3p3 |
| Радиус атома | 128 пм |
| Химические свойства | |
| Ковалентный радиус | 106 пм |
| Радиус иона | 35 (+5e) 212 (-3e) пм |
| Электроотрицательность | 2,19 [1] (шкала Полинга) |
| Электродный потенциал | |
| Степени окисления | 5, 3, 1, 0, −1, −3[2] |
| Энергия ионизации (первый электрон) | 1011,2(10,48) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | (белый фосфор)1,82 г/см³ |
| Температура плавления | 317,3 K |
| Температура кипения | 553 K |
| Теплота плавления | 2,51 кДж/моль |
| Теплота испарения | 49,8 кДж/моль |
| Молярная теплоёмкость | 21,6[3] (ромбич.) Дж/(K·моль) |
| Молярный объём | 17,0 см³/моль |
Хлор
| Хлор | |
| Cl 35,452 | |
| 3s23p5 |
Хлор (от греч. χλωρός — «зелёный») — элемент 17-й группы периодической таблицы химических элементов (по устаревшей классификации — элемент главной подгруппы VII группы), третьего периода, с атомным номером 17[2]. Обозначается символом Cl (лат. Chlorum). Химически активный неметалл. Входит в группу галогенов (первоначально название «галоген» использовал немецкий химик Швейгер для хлора — дословно «галоген» переводится как солерод — но оно не прижилось и впоследствии стало общим для 17-й (VIIA) группы элементов, в которую входит и хлор).
Простое вещество хлор (CAS-номер: 7782-50-5) при нормальных условиях — ядовитый газ желтовато-зелёного цвета тяжелее воздуха, с резким запахом. Молекула хлора двухатомная (формула Cl2).
| ||||
| Внешний вид простого вещества | ||||
 Жидкий хлор в запаянном сосуде Жидкий хлор в запаянном сосуде
| ||||
| Свойства атома | ||||
| Имя, символ, номер | Хлор / Chlorum (Cl), 17 | |||
| Атомная масса (молярная масса) | 35,4527 а. е. м. (г/моль) | |||
| Электронная конфигурация | [Ne] 3s2 3p5 | |||
| Радиус атома | 100 пм | |||
| Химические свойства | ||||
| Ковалентный радиус | 99 пм | |||
| Радиус иона | (+7e)27 (-1e)181 пм | |||
| Электроотрицательность | 3,16 (шкала Полинга) | |||
| Электродный потенциал | ||||
| Степени окисления | 7, 6, 5, 4, 3, 1, −1 | |||
| Энергия ионизации (первый электрон) | 1254,9(13,01) кДж/моль (эВ) | |||
| Термодинамические свойства простого вещества | ||||
| Плотность (при н. у.) | 3,214 г/л; (жид. при −35 °C) 1,557; (тв. при −105 °C) 1,9 г/см³ | |||
| Температура плавления | 172,2 K | |||
| Температура кипения | 238,6 K | |||
| Критическая точка | 416,9 К, 7,991 Мпа | |||
| Теплота плавления | 6,41 кДж/моль | |||
| Теплота испарения | 20,41 кДж/моль | |||
| Молярная теплоёмкость | 21,838[1] Дж/(K·моль) | |||
| Молярный объём | 18,7 см³/моль | |||
| Кристаллическая решётка простого вещества | ||||
| Структура решётки | Орторомбическая | |||
| Параметры решётки | a=6,29 b=4,50 c=8,21 Å | |||
| Прочие характеристики | ||||
| Теплопроводность | (300 K) 0,009 Вт/(м·К) |
При нагревании РCl5 и NH4Cl происходит реакция образования полимера фосфонитрилхлорида:
nPCl5 + nNH4Cl → (PNCl2)n + 4nHCl
(PNCl2)n — прозрачное эластичное вещество, «неорганический каучук». Выдерживает нагревание выше 200 °C. К сожалению, фосфонитрилхлорид сравнительно легко гидролизуется, что затрудняет его практическое использование. Заменой атомов Cl на органические радикалы можно получить водоустойчивые полимеры.
Получение
Получают действием избытка хлора на хлорид фосфора(III):
PCl3 + Cl2 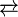 PCl5 ΔH = −124 кДж/моль
PCl5 ΔH = −124 кДж/моль
Применение
PCl5 — сильный хлорирующий агент, его используют при получении хлорангидридов фосфорных и фосфоновых кислот из олефинов, в производстве лекарственных средств и красителей.
Токсичность
Токсичен, ПДК 0,2 мг/м3.
История открытия хлора
Соединение с водородом — газообразный хлороводород — было впервые получено Джозефом Пристли в 1772 г. Хлор был получен в 1774 г. шведским химиком Карлом Вильгельмом Шееле, описавшим его выделение при взаимодействии пиролюзитас соляной кислотой в своём трактате о пиролюзите:
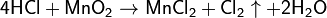
Шееле отметил запах хлора, схожий с запахом царской водки, его способность взаимодействовать с золотом и киноварью, а также его отбеливающие свойства. Однако Шееле, в соответствии с господствовавшей в химии того времени теориифлогистона, предположил, что хлор представляет собой дефлогистированную муриевую (соляную) кислоту. Бертолле и Лавуазье в рамках кислородной теории кислот обосновали, что новое вещество должно быть оксидом гипотетического элемента мурия. Однако попытки его выделения оставались безуспешными вплоть до работ Дэви, которому электролизомудалось разложить поваренную соль на натрий и хлор, доказав элементарную природу последнего.
Распространение в природе
В природе встречаются два изотопа хлора 35Cl и 37Cl. В земной коре хлор самый распространённый галоген. Хлор очень активен — он непосредственно соединяется почти со всеми элементами периодической системы. Поэтому в природе он встречается только в виде соединений в составе минералов: галита NaCl, сильвина KCl, сильвинита KCl · NaCl, бишофитаMgCl2 · 6Н2О, карналлита KCl · MgCl2 · 6Н2O, каинита KCl · MgSO4 · 3Н2О. Самые большие запасы хлора содержатся в составе солей вод морей и океанов (содержание в морской воде 19 г/л[4]). На долю хлора приходится 0,025 % от общего числа атомов земной коры; кларковое число хлора — 0,017 %. Человеческий организм содержит 0,25 % ионов хлора по массе. В организме человека и животных хлор содержится в основном в межклеточных жидкостях (в том числе в крови) и играет важную роль в регуляции осмотических процессов, а также в процессах, связанных с работой нервных клеток.
Изотопный состав
В природе встречаются 2 стабильных изотопа хлора: с массовым числом 35 и 37. Доли их содержания соответственно равны 75,78 % и 24,22 %[5].
| Изотоп | Относительная масса, а.е.м. | Период полураспада | Тип распада | Ядерный спин |
| 35Cl | 34,968852721 | Стабилен | — | 3/2 |
| 36Cl | 35,9683069 | 301000 лет | β-распад в 36Ar | |
| 37Cl | 36,96590262 | Стабилен | — | 3/2 |
| 38Cl | 37,9680106 | 37,2 минуты | β-распад в 38Ar | |
| 39Cl | 38,968009 | 55,6 минуты | β-распад в 39Ar | 3/2 |
| 40Cl | 39,97042 | 1,38 минуты | β-распад в 40Ar | |
| 41Cl | 40,9707 | 34 c | β-распад в 41Ar | |
| 42Cl | 41,9732 | 46,8 c | β-распад в 42Ar | |
| 43Cl | 42,9742 | 3,3 c | β-распад в 43Ar |
Физические и химические свойства
При нормальных условиях хлор — жёлто-зелёный газ с удушающим запахом. Некоторые его физические свойства представлены в таблице.
| Свойство | Значение |
| Цвет (газ) | Жёлто-зелёный |
| Температура кипения | −34 °C |
| Температура плавления | −100 °C |
| Температура разложения (диссоциации на атомы) | ~1400 °C |
| Плотность (газ, н.у.) | 3,214 г/л |
| Сродство к электрону атома | 3,65 эВ |
| Первая энергия ионизации | 12,97 эВ |
| Теплоемкость (298 К, газ) | 34,94 (Дж/моль·K) |
| Критическая температура | 144 °C |
| Критическое давление | 76 атм |
| Стандартная энтальпия образования (298 К, газ) | 0 (кДж/моль) |
| Стандартная энтропия образования (298 К, газ) | 222,9 (Дж/моль·K) |
| Энтальпия плавления | 6,406 (кДж/моль) |
| Энтальпия кипения | 20,41 (кДж/моль) |
| Энергия гомолитического разрыва связи Х-Х | 243 (кДж/моль) |
| Энергия гетеролитического разрыва связи Х-Х | 1150 (кДж/моль) |
| Энергия ионизации | 1255 (кДж/моль) |
| Энергия сродства к электрону | 349 (кДж/моль) |
| Атомный радиус | 0,073 (нм) |
| Электроотрицательность по Полингу | 3,20 |
| Электроотрицательность по Оллреду-Рохову | 2,83 |
| Устойчивые степени окисления | −1, 0, +1, +3, (+4), +5, (+6), +7 |
Газообразный хлор относительно легко сжижается. Начиная с давления в 0,8 МПа (8 атмосфер), хлор будет жидким уже при комнатной температуре. При охлаждении до температуры в −34 °C хлор тоже становится жидким при нормальном атмосферном давлении. Жидкий хлор — жёлто-зелёная жидкость, обладающая очень высоким коррозионным действием (за счёт высокой концентрации молекул). Повышая давление, можно добиться существования жидкого хлора вплоть до температуры в +144 °C (критической температуры) при критическом давлении в 7,6 МПа.
При температуре ниже −101 °C жидкий хлор кристаллизуется в орторомбическую решётку с пространственной группой Cmca и параметрами a=6,29 Å b=4,50 Å, c=8,21 Å[7]. Ниже 100 К орторомбическая модификация кристаллического хлора переходит в тетрагональную, имеющую пространственную группу P42/ncm и параметры решётки a=8,56 Å и c=6,12 Å[7].
Растворимость
| Растворитель | Растворимость г/100 г |
| Бензол | Растворим |
| Вода[8] (0 °C) | 1,48 |
| Вода (20 °C) | 0,96 |
| Вода (25 °C) | 0,65 |
| Вода (40 °C) | 0,46 |
| Вода (60 °C) | 0,38 |
| Вода (80 °C) | 0,22 |
| Тетрахлорметан (0 °C) | 31,4 |
| Тетрахлорметан (19 °C) | 17,61 |
| Тетрахлорметан (40 °C) | |
| Хлороформ | Хорошо растворим |
| TiCl4, SiCl4, SnCl4 | Растворим |
Степень диссоциации молекулы хлора Cl2 → 2Cl при 1000 К равна 2,07·10−4%, а при 2500 К 0,909 %.
Порог восприятия запаха в воздухе равен 0,003 (мг/л).
По электропроводности жидкий хлор занимает место среди самых сильных изоляторов: он проводит ток почти в миллиард раз хуже, чем дистиллированная вода, и в 1022 раз хужесеребра. Скорость звука в хлоре примерно в полтора раза меньше, чем в воздухе.
Химические свойства
Строение электронной оболочки
На валентном уровне атома хлора содержится 1 неспаренный электрон: 1s2 2s2 2p6 3s2 3p5, поэтому валентность равная 1 для атома хлора очень стабильна. За счёт присутствия в атоме хлора незанятой орбитали d-подуровня, атом хлора может проявлять и другие степени окисления. Схема образования возбуждённых состояний атома:
| Валентность | Возможные степени окисления | Электронное состояние валентного уровня | Пример соединений |
| I | +1, −1, 0 | 3s2 3p5 | NaCl, NaClO, Cl2 |
| III | +3 | 3s2 3p4 3d1 | NaClO2 |
| V | +5 | 3s2 3p3 3d2 | KClO3 |
| VII | +7 | 3s1 3p3 3d3 | KClO4 |
Также известны соединения хлора, в которых атом хлора формально проявляет валентность 4 и 6, например ClO2 и Cl2O6. Однако, эти соединения являются радикалами, то есть у них есть один неспаренный электрон.
Взаимодействие с металлами
Хлор непосредственно реагирует почти со всеми металлами (с некоторыми только в присутствии влаги или при нагревании):
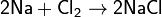
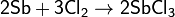
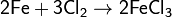
Взаимодействие с неметаллами
C неметаллами (кроме углерода, азота, кислорода и инертных газов), образует соответствующие хлориды.
На свету или при нагревании активно реагирует (иногда со взрывом) с водородом по радикальному механизму. Смеси хлора с водородом, содержащие от 5,8 до 88,3 % водорода, взрываются при облучении с образованием хлороводорода. Смесь хлора с водородом в небольших концентрациях горит бесцветным или желто-зелёным пламенем. Максимальная температура водородно-хлорного пламени 2200 °C.:
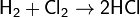
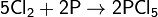
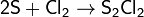
С кислородом хлор образует оксиды в которых он проявляет степень окисления от +1 до +7: Cl2O, ClO2, Cl2O5, Cl2O7. Они имеют резкий запах, термически и фотохимически нестабильны, склонны к взрывному распаду.
При реакции с фтором, образуется не хлорид, а фторид: 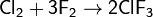
Другие свойства
Хлор вытесняет бром и иод из их соединений с водородом и металлами:
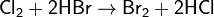
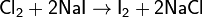
При реакции с монооксидом углерода образуется фосген:
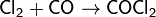
При растворении в воде или щелочах, хлор диспропорционирует, образуя хлорноватистую (а при нагревании хлорноватую) и соляную кислоты, либо их соли:
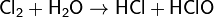
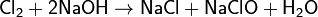
(при нагревании)
Хлорированием сухого гидроксида кальция получают хлорную известь:
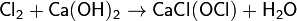
Действием хлора на аммиак можно получить трихлорид азота:
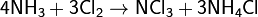
Окислительные свойства хлора
Хлор — очень сильный окислитель:
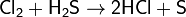
Раствор хлора в воде используется для отбеливания тканей и бумаги.
Реакции с органическими веществами
С насыщенными соединениями:
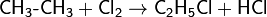
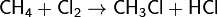 (получение хлороформа, реакция идет многоступенчато с образованием тетрахлорметана CCl4)
(получение хлороформа, реакция идет многоступенчато с образованием тетрахлорметана CCl4)
Присоединяется к ненасыщенным соединениям по кратным связям:
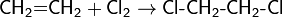
Ароматические соединения замещают атом водорода на хлор в присутствии катализаторов (например, AlCl3 или FeCl3):
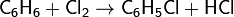
Химические методы
Химические методы получения хлора малоэффективны и затратны. На сегодняшний день имеют в основном историческое значение. Может быть получен при взаимодействии перманганата калия с соляной кислотой:
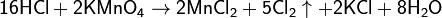
Стандарты качества хлора
Согласно ГОСТ 6718-93 «Хлор жидкий. Технические условия» производятся следующие сорта хлора
| Наименование показателя ГОСТ 6718-93 | Высший сорт | Первый сорт |
| Объемная доля хлора, не менее, % | 99,8 | 99,6 |
| Массовая доля воды, не более, % | 0,01 | 0,04 |
| Массовая доля треххлористого азота, не более, % | 0,002 | 0,004 |
| Массовая доля нелетучего остатка, не более, % | 0,015 | 0,10 |
Применение

Хлор применяют во многих отраслях промышленности, науки и бытовых нужд:
Оконный профиль, изготовленный из хлорсодержащихполимеров
В производстве поливинилхлорида, пластикатов, синтетического каучука, из которых изготавливают: изоляцию для проводов, оконный профиль,упаковочные материалы, одежду и обувь, линолеум и грампластинки, лаки, аппаратуру и пенопласты, игрушки, детали приборов, строительные материалы. Поливинилхлорид производят полимеризацией винилхлорида, который сегодня чаще всего получают из этилена сбалансированным по хлору методом через промежуточный 1,2-дихлорэтан.
· Отбеливающие свойства хлора известны с давних времен, хотя не сам хлор «отбеливает», а атомарный кислород, который образуется при распаде хлорноватистой кислоты:
· Cl2 + H2O → HCl + HClO → 2HCl + O•. Этот способ отбеливания тканей, бумаги, картона используется уже несколько веков.
· Производство хлорорганических инсектицидов — веществ, убивающих вредных для посевов насекомых, но безопасные для растений. На получение средств защиты растений расходуется значительная часть производимого хлора. Один из самых важных инсектицидов — гексахлорциклогексан (часто называемый гексахлораном). Это вещество впервые синтезировано ещё в 1825 г. Фарадеем, но практическое применение нашло только через 100 с лишним лет — в 30-х годах ХХ столетия.
· Использовался как боевое отравляющее вещество, а также для производства других боевых отравляющих веществ: иприт, фосген.
· Для обеззараживания воды — «хлорирования». Наиболее распространённый способ обеззараживания питьевой воды; основан на способности свободного хлора и его соединений угнетать ферментные системы микроорганизмов катализирующие окислительно-восстановительные процессы. Для обеззараживания питьевой воды применяют: хлор, двуокись хлора, хлорамин и хлорную известь. СанПиН 2.1.4.1074-01 [1] устанавливает следующие пределы (коридор) допустимого содержания свободного остаточного хлора в питьевой воде централизованного водоснабжения 0.3 — 0.5 мг/л. Ряд учёных и даже политиков в России критикуют саму концепцию хлорирования водопроводной воды. Альтернативой является озонирование. Материалы, из которых изготовлены водопроводные трубы, по разному взаимодействуют с хлорированной водопроводной водой. Свободный хлор в водопроводной воде существенно сокращает срок службы трубопроводов на основе полиолефинов: полиэтиленовых труб различного вида, в том числе сшитого полиэтилена, большие известного как ПЕКС (PEX, PE-X). В США для контроля допуска трубопроводов из полимерных материалов к использованию в водопроводах с хлорированной водой вынуждены были принять 3 стандарта: ASTM F2023 применительно к трубам из сшитого полиэтилена (PEX) и горячей хлорированной воде, ASTM F2263 применительно к полиэтиленовым трубам всем и хлорированной воде и ASTM F2330 применительно к многослойным (металлополимерным) трубам и горячей хлорированной воде. В части долговечности при взаимодействии с хлорированной водой положительные результаты демонстрируют медные водопроводные трубы.
· В пищевой промышленности зарегистрирован в качестве пищевой добавки E925.
· В химическом производстве соляной кислоты, хлорной извести, бертолетовой соли, хлоридов металлов, ядов, лекарств, удобрений.
· В металлургии для производства чистых металлов: титана, олова, тантала, ниобия.
· Как индикатор солнечных нейтрино в хлор-аргонных детекторах.
Многие развитые страны стремятся ограничить использование хлора в быту, в том числе потому, что при сжигании хлорсодержащего мусора образуется значительное количество диоксинов.
Биологическая роль

Солерос
Хлор относится к важнейшим биогенным элементам и входит в состав всех живых организмов в виде соединений.
У животных и человека, ионы хлора участвуют в поддержании осмотического равновесия, хлорид-ион имеет оптимальный радиус для проникновения через мембрану клеток. Именно этим объясняется его совместное участие с ионами натрия и калия в создании постоянного осмотического давления и регуляции водно-солевого обмена. Под воздействием ГАМК (нейромедиатор) ионы хлора оказывают тормозящий эффект на нейроны путём сниженияпотенциала действия. В желудке ионы хлора создают благоприятную среду для действия протеолитических ферментовжелудочного сока. Хлорные каналы представлены во многих типах клеток, митохондриальных мембранах и скелетных мышцах. Эти каналы выполняют важные функции в регуляции объёма жидкости, трансэпителиальном транспорте ионов и стабилизации мембранных потенциалов, участвуют в поддержании рН клеток. Хлор накапливается в висцеральной ткани, коже и скелетных мышцах. Всасывается хлор, в основном, в толстом кишечнике. Всасывание и экскреция хлора тесно связаны с ионами натрия и бикарбонатами, в меньшей степени с минералокортикоидами и активностью Na+/K+ — АТФ-азы. В клетках аккумулируется 10-15 % всего хлора, из этого количества от 1/3 до 1/2 — в эритроцитах. Около 85 % хлора находятся во внеклеточном пространстве. Хлор выводится из организма в основном с мочой (90-95 %), калом (4-8 %) и через кожу (до 2 %). Экскреция хлора связана с ионами натрия и калия, и реципрокно с HCO3− (кислотно-щелочной баланс).
Человек потребляет 5-10 г NaCl в сутки. Минимальная потребность человека в хлоре составляет около 800 мг в сутки. Младенец получает необходимое количество хлора через молоко матери, в котором содержится 11 ммоль/л хлора. NaCl необходим для выработки в желудке соляной кислоты, которая способствует пищеварению и уничтожению болезнетворных бактерий. В настоящее время участие хлора в возникновении отдельных заболеваний у человека изучено недостаточно хорошо, главным образом из-за малого количества исследований. Достаточно сказать, что не разработаны даже рекомендации по норме суточного потребления хлора. Мышечная ткань человека содержит 0,20-0,52 % хлора, костная — 0,09 %; в крови — 2,89 г/л. В организме среднего человека (масса тела 70 кг) 95 г хлора. Ежедневно с пищей человек получает 3-6 г хлора, что с избытком покрывает потребность в этом элементе.
Ионы хлора жизненно необходимы растениям. Хлор участвует в энергетическом обмене у растений, активируя окислительное фосфорилирование. Он необходим для образования кислорода в процессе фотосинтеза изолированными хлоропластами, стимулирует вспомогательные процессы фотосинтеза, прежде всего те из них, которые связаны с аккумулированием энергии. Хлор положительно влияет на поглощение корнями кислорода, соединений калия, кальция, магния. Чрезмерная концентрация ионов хлора в растениях может иметь и отрицательную сторону, например, снижать содержание хлорофилла, уменьшать активность фотосинтеза, задерживать рост и развитие растений.
Но существуют растения, которые в процессе эволюции либо приспособились к засолению почв, либо в борьбе за пространство заняли пустующие солончаки на которых нет конкуренции. Растения произрастающие на засоленных почвах называются — галофиты, они накапливают хлориды в течение вегетационного сезона, а потом избавляются от излишков посредством листопада или выделяют хлориды на поверхность листьев и веток и получают двойную выгоду притеняя поверхности от солнечного света.
Среди микроорганизмов, так же известны галофилы — галобактерии — которые обитают в сильносоленых водах или почвах.
Токсичность
Хлор — токсичный удушливый газ, при попадании в лёгкие вызывает ожог лёгочной ткани, удушье. Раздражающее действие на дыхательные пути оказывает при концентрации в воздухе около 0,006 мг/л (то есть в два раза выше порога восприятия запаха хлора).
ПДК хлора в атмосферном воздухе следующие: среднесуточная — 0,03 мг/м³; максимально разовая — 0,1 мг/м³; в рабочих помещениях промышленного предприятия — 1 мг/м³.
При работе с хлором следует пользоваться защитной спецодеждой, противогазом, перчатками. На короткое время защитить органы дыхания от попадания в них хлора можно тряпичной повязкой, смоченной раствором сульфита натрия Na2SO3 или тиосульфата натрия Na2S2O3.
Хлор был одним из первых химических отравляющих веществ, использованных Германией в Первую мировую войну, впервые применен в 1915 году во время битвы при Ипре.
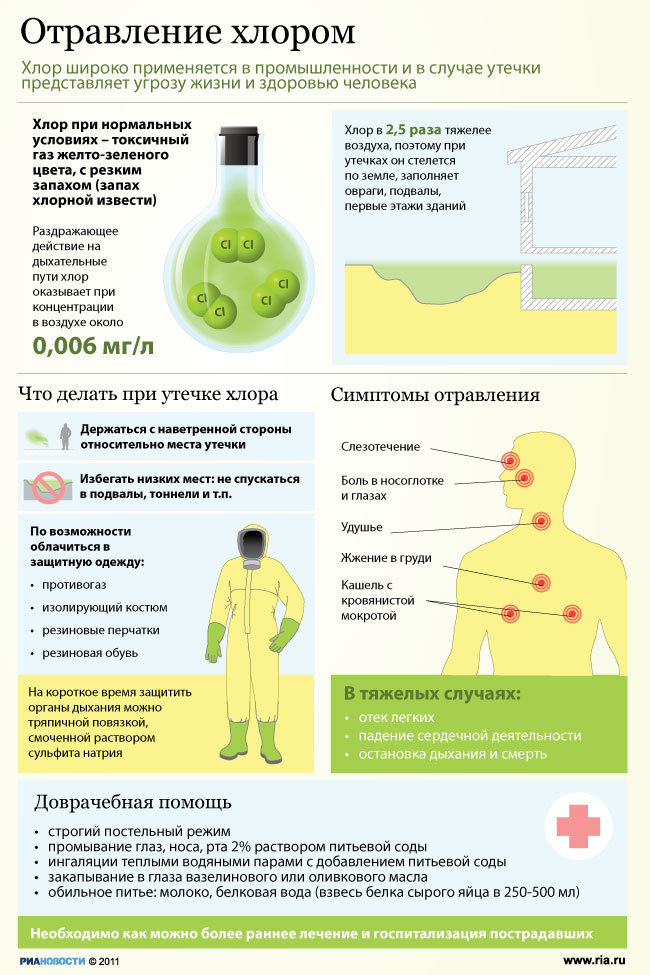


| Стирол | |
| |
| |
| Общие | |
| Химическая формула | C8H8 |
| Физические свойства | |
| Молярная масса | 104.15 г/моль |
| Плотность | 0.909 г/см³ |
| Термические свойства | |
| Температура плавления | -30 °C |
| Температура кипения | 145 °C |
| Классификация | |
| Рег. номер CAS | 100-42-5 |
| SMILES | c1ccccc1C=C |
Стирол
Стиро́л C8H8 (фенилэтилен, винилбензол, этиленбензол) — бесцветная жидкость со специфическим запахом. Стирол практически нерастворим в воде, хорошо растворим в органических растворителях, хороший растворитель полимеров. Стирол относится ко второму классу опасности.
Получение
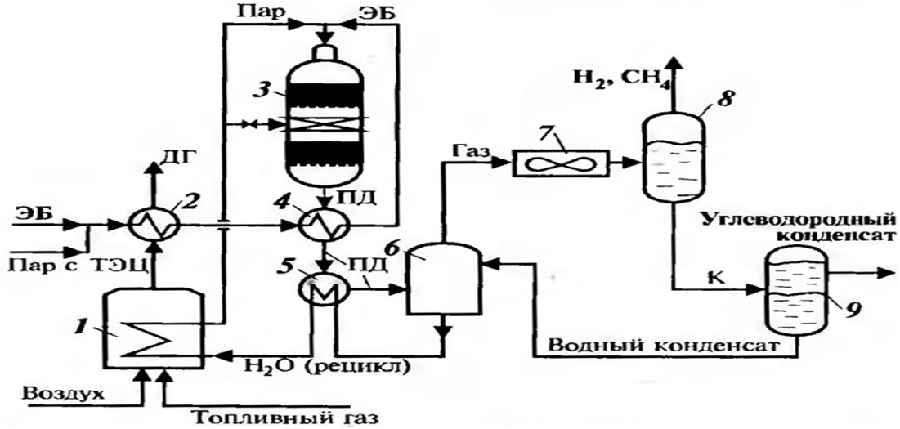
Большую часть стирола (около 85 %) в промышленности получают дегидрированием этилбензола при температуре 600—650°С, атмосферном давлении и разбавлении перегретым водяным паром в 3 — 10 раз. Используются оксидные железо-хромовые катализаторы с добавкой карбоната калия.
Другой промышленный способ, которым получают оставшиеся 15 %, заключается в дегидратации метилфенилкарбинола, образующегося в процессе получения оксида пропилена из гидропероксида этилбензола. Гидропероксид этилбензола получают из этилбензола некаталитическимокислением воздухом.
Разрабатываются альтернативные способы получения стирола. Каталитическая циклодимеризация бутадиена в винилциклогексен, с его последующим дегидрированием. Окислительное сочетание толуола с образованием стильбена; метатезис стильбена с этиленом приводит к стиролу. Взаимодействием толуола с метанолом также может быть получен стирол. Кроме того, активно разрабатывались способы выделения стирола из жидких продуктов пиролиза. На сегодняшний день, ни один из этих процессов не является экономически выгодным и в промышленном масштабе не реализован.
В лабораторных условиях может быть получен нагреванием до 320 °С полистирола с его моментальным отведением.
Свойства
Стирол легко окисляется, присоединяет галогены, полимеризуется (образуя твердую стекловидную массу — полистирол) и сополимеризуется с различными мономерами. Полимеризация происходит уже при комнатной температуре (иногда со взрывом), поэтому при хранении стирол стабилизируют антиоксидантами (например, третбутилпирокатехином, гидрохиноном). Галогенирование, например, в реакции с бромом, в отличие от анилина идёт не по бензольному кольцу, а по виниловой группе с образованием (1,2-дибромэтил)бензола.
Применение
Стирол применяют почти исключительно для производства полимеров. Многочисленные виды полимеров на
 15P
15P



