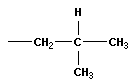
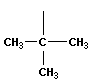
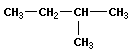
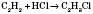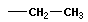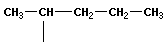Вещества, имеющие одинаковый состав, но разное химическое или пространственное строение, а следовательно, и разные свойства, называют изомерами. Основные виды изомерии:
Структурная изомерия, при которой вещества различаются порядком связи атомов в молекулах:
1) изомерия углеродного скелета

2) изомерия гомологических рядов (межклассовая)
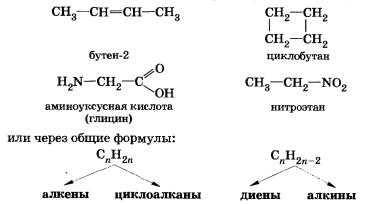
Пространственная изомерия, при которой молекулы веществ отличаются не порядком связи атомов, а положением их в пространстве: цис-транс-изомерия (геометрическая).
Эта изомерия характерна для веществ, молекулы которых имеют плоское строение: алкенов, циклоалканов и др.
Если два атома Углерода образуют двойную связь, то валентные орбитали каждого из них находятся в состоянии sp 2 - гибридизации. Каждый из атомов Углерода образует по три связи, которые находятся в одной плоскости и направлены к вершинам равностороннего треугольника. Связь между атомами Углерода расположен в плоскости, что является перпендикулярной к плоскости, в которой расположены связи. То есть, связи и связь расположены во взаимно перпендикулярных плоскостях.

Рассмотренное строение молекул с двойной связью обусловливает так называемую цис - и транс - изомерию. К цис - изомеров относят такие, которые имеют одинаковые заместители по одну сторону от плоскости, в которой расположена связь. К транс -изомерам относят такие, которые имеют одинаковые заместители по разные стороны от плоскости, в которой расположена связь.
К пространственной изомерии относится и оптическая (зеркальная) изомерия.
Четыре одинарные связи вокруг атома углерода, как вы уже знаете, расположены тетраэдрически.
Если атом углерода связан с четырьмя различными атомами или группами, то возможно разное расположение этих групп в пространстве, то есть две пространственные изомерные формы.
Представьте себе, что молекулу аланина поместили перед зеркалом. Группа —NH2 находится ближе к зеркалу, поэтому в отражении она будет впереди, а группа —СООН — на заднем плане и т. д. (см. изображение справа). Алании существует в двух пространственных формах, которые при наложении не совмещаются одна с другой.
Динамическая изомерия (таутомерия) определяется сосуществованием различных изомеров, которые при обычных условиях могут переходить один в другой.
Глюкоза может образовывать одну линейную и две циклические формы сосуществуют при обычных условиях:

β- Глюкоза и α-глюкоза отличаются положением гидроксогрупп у атома Углерода С1.

Универсальность второго положения теории строения химических соединений подтверждает существование неорганических изомеров.
Так, первый из синтезов органических веществ — синтез мочевины, проведенный Велером (1828 г.), показал, что изомерны неорганическое вещество — цианат аммония и органическое — мочевина:

Если заменить атом кислорода в мочевине на атом серы, то получится тиомочевина, которая изомерна роданиду аммония, хорошо известному вам реактиву на ионы Fе3+. Очевидно, что тиомочевина не дает этой качественной реакции.
Третье положение. Свойства веществ зависят от взаимного влияния атомов в молекулах.Например, в уксусной кислоте в реакцию со щелочью вступает только один из четырех атомов водорода. На основании этого можно предположить, что только один атом водорода связан с кислородом:

Чтобы убедиться в универсальности положения теории строения о зависимости свойств веществ от взаимного влияния атомов в молекулах, которое существует не только у органических, но и у неорганических соединений, сравним свойства атомов водорода в водородных соединениях неметаллов. Они имеют молекулярное строение и в обычных условиях представляют собой газы или летучие жидкости. В зависимости от положения неметалла в Периодической системе Д. И. Менделеева можно выявить закономерность в изменении свойств таких соединений:

Метан не взаимодействует с водой. Отсутствие основных свойств у метана объясняется насыщенностью валентных возможностей атома углерода.
Аммиак проявляет основные свойства. Его молекула способна присоединять к себе ион водорода за счет его притяжения к не поделённой электронной паре атома азота (донорно-акцепторный механизм образования связи).
В периодах слева направо увеличиваются заряды ядер атомов, уменьшаются радиусы атомов, увеличивается сила отталкивания атома водорода с частичным положительным зарядом §+, а потому кислотные свойства водородных соединений неметаллов усиливаются.

4. Значение теории химического строения А. М. Бутлерова для органической химии можно сравнить со значением Периодического закона и Периодической системы химических элементов Д. И. Менделеева для неорганической химии.
Теория объяснила неясности и противоречия в знаниях об окружающем мире; творчески обобщила достижения в области химии; представила качественно новый подход к пониманию строения и свойств веществ; указала направления и возможные пути получения новых веществ, необходимых людям.
Номенклатура органических веществ и ее виды. Номенклатура – совокупность названий индивидуальных химических веществ, их групп и классов, а также правила составления их названий. Название вещества должно отражать не только его качественный и количественный состав, но и однозначно показывать его химическое строение, названию должна соответствовать единственная формула строения.
В настоящее время для наименования органических соединений применяются три типа номенклатуры: тривиальная, рациональная и систематическая номенклатура — номенклатура IUPAC (ИЮПАК) — (Международного союза теоретической и прикладной химии).
(Вспомним русский язык. Из каких частей состоит слово?: Приставка, корень, суффиксы, окончание.)
Название органического соединения так же состоит из приставки (префикса), корня, суффикса первого порядка, суффикса второго порядка. Корень слова определяет основную цепь органического соединения, зависит от количества атомов в цепи.
Префиксы указывают на наличие функциональной группы (кроме старшей), радикалы. Радикалы образованы из предельных углеводородов отнятием водорода от конечного углеродного атома называют заменяя суффикс «ан в названии углеводорода суффиксом «ил». Например, метан- метил.(Кассы неорганических соединений и название характеристических групп.)
Суффикс первого порядка указывает на определенный вид связи атомов углерода в соединении. Суффикс второго порядка указывает на наличие старшей функциональной группы.
В названии органического соединения используют локанты и множительные приставки. Локанты – цифры или буквы указывающие положение заместителей и кратных связей. Они могут ставятся перед префиксом или после суффикса. Множительные приставки указывают число одинаковых заместителей или кратных связей. (ди-, три-, тетро-, пенто-) Составления структурных формул по названию органического соединения. Разберем на составные части название органического соединения:
3-этилпентан.
Определим корень (слово, указывающее наибольшее количество атомов углерода) пент. Выделим значком для корня. Перед корнем выделяем префикс 3-этил. После корня укажем суффикс «ан».

Составим структурную формулу по плану:
1. Составляем цепь из углеродов, в количестве указанном в корне.
2. Прономеруем атомы углерода.
3. Укажем радикал у третьего атома углерода, согласно префиксу.
4. Суффикс «ан» указывает на одинарную связь между атомами углерода.
5. Допишем недостающие атомы водорода, согласно валентности.

Составьте, самостоятельно, в тетрадях структурную формулу
2-метилбутанол-2.
А 15 B молекуле этилена имеются
| 1) | две s- и две p-связи |
| 2) | две s- и три p-связи 
|
| 3) | пять s- и одна p-связь Корень эт - С2; Суффикс илен = связь |
| 4) | три s- и две p-связи
проставим недостающие атомы водорода
 Ответ: пять s- и одна p-связь. А 15—3
Ответ: пять s- и одна p-связь. А 15—3
|
Составления названий органических соединений по структурной формуле.
Выполним обратное задание. Составим название органического соединения по ее структурной формуле. (Прочитайте правила составления названий органических соединений. Составите название органического соединения по структурной формуле.)

4. Многообразие органических соединений.
Ежедневно количество добытых и описанных химиками органических веществ возрастает почти на тысячу. Сейчас их известно около 20 миллионов (неорганических соединений существует в десятки раз меньше).
Причиной многообразия органических соединений является уникальность атомов Карбона, а именно:
- достаточно высокая валентность - 4;
- возможность создания простых, двойных и тройных ковалентных связей;
- способность сочетаться друг с другом;
- возможность образования линейных цепей, разветвленных, а также замкнутых, которые называют циклами.
Среди органических веществ наибольшее соединений Карбона с Гидрогеном; их называют углеводородами. Это название происходит от старых названий элементов - "углерод" и "водород".
Современная классификация органических соединений базируется на теории химического строения. В основу классификации положены особенности строения углеродной цепи углеводородов, поскольку они просты по составу и в большинстве известных органических веществ углеводородные радикалы составляют основную часть молекулы.
5. Классификация насыщенных углеводородов.
Органические соединения можно классифицировать:
1) по структуре их карбонового каркаса. В основе такой классификации лежат четыре главных класса органических соединений (алифатические соединения, алициклические соединения, ароматические соединения и гетероциклические соединения);
2) по функциональным группам.

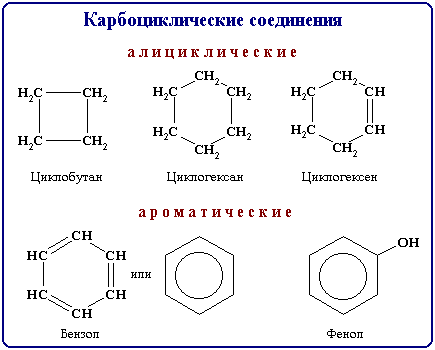
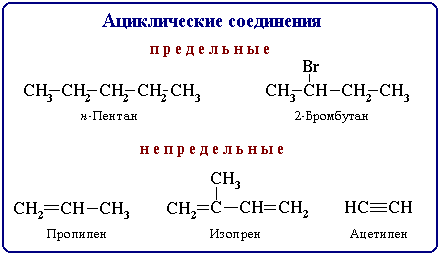
Ациклические ( нециклические, цепные) соединения называют также жирными или алифатическими. Эти названия связаны с тем, что одними из первых хорошо изученных соединений такого типа были природные жиры.
Среди разнообразия органических соединений можно выделить группы веществ, которые сходны по своим свойствам и отличаются между собой на группу - СН2.
Ø Соединения, сходные по химическим свойствам и состав которых отличается между собой на группу - СН2, называются гомологами.
Ø Гомологи, расположенные в порядке возрастания их относительной молекулярной массы, образуют гомологический ряд.
Ø Группа - СН22, называется гомологической разностью.
Примером гомологического ряда может быть ряд насыщенных углеводородов (алканов). Самый простой его представитель - метан СН4. Окончание - ан характерно для названий предельных углеводородов. Далее идут этан С2Н6, пропан СзН8, бутан С4Н10. Начиная с пятого углеводорода, название образуется из греческого числительного, указывающего число углеродных атомов в молекуле, и окончание -ан. Это пентан С5Н12, гексан С6Н14, гептан С7Н16, октан С8Н18, нонан СдН20, декан С10Н22 и т. д.
Формулу любого следующего гомолога можно получить добавлением к формуле предыдущего углеводорода гомологической разности.
Четыре С-Н связи, например, в метане, равноценны и размещены симметрично (тетраэдрично) под углом 109028 относительно друг друга. Это объясняется тем, что одна 2s и три 2p-орбитали объединяются так, чтобы образовать четыре новые (идентичные) орбитали, способные дать более прочные связи. Эти орбитали направлены к вершинам тетраэдра - такого размещения, когда орбитали максимально удалены друг от друга. Такие новые орбитали называются sp 3 – гибридизоваными атомными орбиталями.
Наиболее удобной номенклатурой, что дает возможность называть любые соединения, является систематическа я номенклатура органических соединений.
Чаще всего систематические названия основываются на принципе замещения, то есть любое соединение рассматривается как неразветвленный углеводород - ациклический или циклический, в молекуле которого один или несколько атомов Водорода замещены другими атомами и группами, в том числе углеводородными остатками. С развитием органической химии систематическая номенклатура постоянно совершенствуется и дополняется, за этим следит комиссия по номенклатуре Международного союза теоретической и прикладной химии (Internation Union of Pure and Applied Chemistry - IUPAC).
Номенклатура алканов и их производных названия первым десяти членам ряда насыщенных углеводородов уже дано. Чтобы подчеркнуть, что алкан имел неразветвленный углеродный цепь, часто к названию добавляют слово нормальный (н-), например:
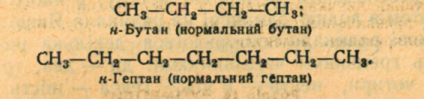
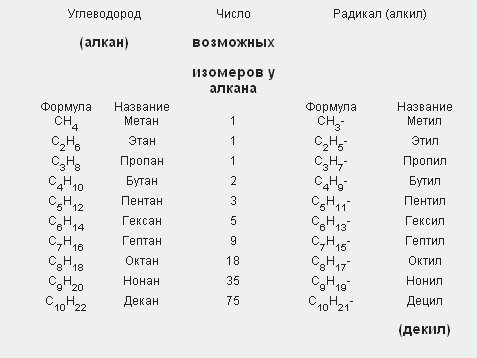
При отрыве атома водорода от молекулы алкана образуются одновалентные частицы, которые называют углеводородными радикалами (сокращенно обозначают буквой R.
Названия одновалентных радикалов происходят от названий соответствующих углеводородов с заменой окончания - ан на -ил (-ил). Вот соответствующие примеры:
Контроль знаний:
1. Что изучает органическая химия?
2. Как отличить органические вещества от неорганических?
3. Элемент обязанностью входит в состав органических соединений?
4. Перелечите типы органических реакций.
5. Запишите изомеры бутана.
6. Какие соединения называются насыщенными?
7. Которые номенклатуры вам известны? В чем заключается их суть?
8. Что такое изомеры? Приведите примеры.
9. Что такое структурная формула?
10. Запишите шестой представитель алканов.
11. Как классифицируют органические соединения?
12. Какие способы разрыва связи вам известны?
13. Перелечите типы органических реакций.
ДОМАШНЕЕ ЗАДАНИЕ
Проработать: Л1. Стр.4-6 Л1. Стр.8-12,пересказ конспекта лекции №8.
Лекция № 9.
Тема: Алканы: гомологический ряд, изомерия и номенклатура алканов. Химические свойства алканов (на примере метана и этана): горение, замещение, разложение и дегидрирование. Применение алканов на основе свойств.
Основные понятия и термины по теме: алканы,гомологический ряд алканов, крекинг, гомологи, гомологическая разность, строение алканов: тип гибридизации – sр3.
План изучения темы
(перечень вопросов, обязательных к изучению):
1. Насыщенные углеводороды: состав, строение, номенклатура.
2.Типы химических реакций, характерные для органических соединений.
3.Физические свойства (на примере метана).
4. Получение предельных углеводородов.
5. Химические свойства.
6.Применение алканов.
Содержание лекции:
1. Насыщенные углеводороды: состав, строение, номенклатура.
Углеводороды - простейшие органические соединения, состоящие из двух элементов: углерода и водорода.
Алканами или насыщенными углеводородами (международное название), называют углеводороды, в молекулах которых атомы Углерода соединены друг с другом простыми (ординарными) связями, а валентности углеродных атомов, которые не принимают участия в их взаимном сочетании, образуют связи с атомами Водорода.
Алканы образуют гомологический ряд соединений, отвечающих общей формуле СnН2n+2, где: п - число атомов углерода.
В молекулах насыщенных углеводородов атомы углерода связаны между собой простой (одинарной) связью, а остальные валентностей насыщены атомами водорода. Алканы называют также парафинами.
Для названия предельных углеводородов применяют в основном систематическую и рациональную номенклатуры.
Правила систематической номенклатуры.
Общее (родовое) название предельных углеводородов — алканы.
Названия первых четырех членов гомологического ряда метана тривиальные: метан, этан, пропан, бутан. Начиная с пятого названия образованы от греческих числительных с добавлением суффикса –ан (этим подчеркивается сходство всех предельных углеводородов с родоначальником этого ряда — метаном).
Для простейших углеводородов изостроения сохраняются их несистематические названия: изобутан, изопентан, неопентад.
По рациональной номенклатуре алканы рассматривают как производные простейшего углеводорода — метана, в молекуле которого один или несколько водородных атомов замещены на радикалы. Эти заместители (радикалы) называют по старшинству (от менее сложных к более сложным). Если эти заместители одинаковые, то указывают их количество. В основу названия включают слово "метан":
| CH3 | H3C—C—CH3 | CH3 | C2H5 | H3C—CH—CH—CH3 | CH3 |
| тетраметилметан (2,2-диметилпропан) | метилэтилизопропилметан (2,3-диметилпентан) |
Свою номенклатуру имеют и радикалы (углеводородные радикалы). Одновалентные радикалы называют алкилами и обозначают буквой R или Alk.
Их общая формула CnH2n+ 1.
Названия радикалов составляют из названий соответствующих углеводородов заменой суффикса -ан на суффикс -ил (метан — метил, этан — этил, пропан — пропил и т.д.).
Двухвалентные радикалы называют, заменяя суффикс -ан на -илиден (исключение - радикал метилен ==СН2).
Трехвалентные радикалы имеют суффикс -илидин (исключение - радикал метин ==СН).
В таблице приведены названия первых пяти углеводородов, их радикалов, возможных изомеров и соответствующие им формулы.
|
2 .Типы химических реакций, характерные для органических соединений
1) Реакции окисления (горения):

Такие реакции характерны для всех представителей гомологических рядов 2) Реакции замещения:

Такие реакции характерны для алканов, аренов (при определенных условиях), а также возможные для представителей других гомологичных рядов.
3) Реакции отщепления: Такие реакции возможны для алканов, алкенов.

4) Реакции присоединения:

Такие реакции возможны для алкенов, алкинов, аренов.
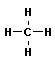
 Простейшая органическое вещество - метан - имеет молекулярную формулу СН4. Структурная формула метана:
Простейшая органическое вещество - метан - имеет молекулярную формулу СН4. Структурная формула метана:

Электронная формула метана:

Молекула метана имеет форму тетраэдра: в центре - атом Углерода, в вершинах - атомы Водорода, соединения направлены к вершинам тетраэдра под углом.
3. Физические свойства метана. Газ без цвета и запаха, легче воздуха, мало растворим в воде. В природе метан образуется при гниении растительных остатков без доступа воздуха.
Метан является основной составной частью природного газа.
Алканы практически нерастворимы в воде, потому что их молекулы малополярные и не взаимодействуют с молекулами воды, но хорошо растворяются в неполярных органических растворителях, таких как бензен, тетрахлорметан. Жидкие алканы легко смешиваются друг с другом.
4. Получение метана.
1) С натрий ацетата:

2) Синтезом из углерода и водорода (400-500 и повышенное давление):

3) С алюминий карбида(в лабораторных условиях):
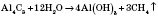
4) Гидрирование (присоединение водорода) непредельных углеводородов:
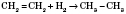
5) Реакция Вюрца, что служит для увеличения карбонной цепи:

5. Химические свойства метана:
1) Не вступают в реакции присоединения.
2) Горят:
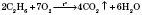
3) Разлагаются при нагревании:
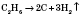
4) Вступают в реакции галогенирование (реакции замещения):
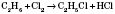
5) При нагревании и под действием катализаторов происходит крекинг - гемолитический разрыв С—С связей. При этом образуются алканы и низшие алканы, например:

6) При дегидрирование метана и этилена образуется ацетилен:

7) Горения:- при достаточном количестве кислорода образуется углекислый газ и вода:
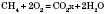
- при недостаточном количестве кислорода образуется угарный газ и вода:
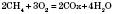
- или углерод и вода:

Смесь метана с воздухом взрывоопасна.
8) Термическое разложение без доступа кислорода на углерод и водород:

6.Применение алканов:
Метан в больших количествах расходуется в качестве топлива. Из него получают водород, ацетилен, сажу. Он используется в органических синтезах, в частности, для получения формальдегида, метанола, муравьиной кислоты и других синтетических продуктов.
При обычных условиях первые четыре члена гомологического ряда алканов  - газы.
- газы.
Нормальные алканы от пентана до гептадекана  - жидкости, начиная с
- жидкости, начиная с 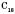 и выше - твердые вещества. По мере увеличения числа атомов в цепи, т.е. с ростом относительной молекулярной массы, возрастают температуры кипения и плавления алканов.
и выше - твердые вещества. По мере увеличения числа атомов в цепи, т.е. с ростом относительной молекулярной массы, возрастают температуры кипения и плавления алканов.
Низшие члены гомологического ряда используются для получения соответствующих непредельных соединений реакцией дегидрирования. Смесь пропана и бутана используется в качестве бытового топлива. Средние члены гомологического ряда применяются как растворители и моторные топлива.
Большое промышленное значение имеет окисление высших предельных углеводородов — парафинов с числом углеродных атомов 20-25. Этим путем получают синтетические жирные кислоты с различной длиной цепи, которые используются для производства мыл, различных моющих средств, смазочных материалов, лаков и эмалей.
Жидкие углеводороды используются как горючее (они входят в состав бензина и керосина). Алканы широко используются в органическом синтезе.
Контроль знаний:
1. Какие соединения называются насыщенные?
2. Которые номенклатуры вам известны? В чем заключается их суть?
3. Что такое изомеры? Приведите примеры.
4. Что такое структурная формула?
5. Запишите шестой представитель алканов.
6. Что такое гомологический ряд и гомологическая разница.
7. Назовите правила, которыми пользуются, когда называют соединения.
8. Определите формулу парафина, 5,6 г которого (н. у.) имеют массу 11г.
ДОМАШНЕЕ ЗАДАНИЕ:
Проработать: Л1. Стр. 25-34,пересказ конспекта лекции №9.
Лекция № 10.
Тема: Алкены. Этилен, его получение (дегидрированием этана и дегидратацией этанола). Химические свойства этилена: горение, качественные реакции ( обесцвечивание бромной воды и раствора перманганата калия), гидратация, полимеризация. Полиэтилен, его свойства и применение. Применение этилена на основе свойств.
Алкины. Ацетилен, его получение пиролизом метана и карбидным способом. Химические свойства ацетилена: горение, обесцвечивание бромной воды, присоединение хлороводорода и гидратация. Применение ацетилена на основе свойств. Реакция полимеризации винилхлорида. Поливинилхлорид и его применение.
Основные понятия и термины по теме: алкены и алкины,гомологический ряд, крекинг, гомологи, гомологическая разность, строение алкенов и алкинов: тип гибридизации.
План изучения темы
(перечень вопросов, обязательных к изучению):
1Ненасыщенные углеводороды: состав.
2.Физические свойства этилена и ацетилена.
3.Строение.
4.Изомерия алкенов и алкинов.
5.Получение непредельных углеводородов.
6.Химические свойства.
Содержание лекции:
1. Ненасыщенные углеводороды: состав:
Углеводороды с общей формулой СnH2n и СnH2n-2, в молекулах которых между атомами углерода имеется двойная связь или тройная связь называются непредельными. Углеводороды с двойной связью относятся к непредельным ряда этилена (называют этиленовыми углеводородами, или алкенами), с тройной – ряда ацетилена.
2.Физические свойства этилена и ацетилена:
Этилен и ацетилен - это бесцветные газы. Они плохо растворяются в воде, но хорошо в бензине, эфире и других неполярных растворителях. Температура кипения тем больше, чем больше их молекулярная масса. В сравнении с алканами, алкины имеют более высокие температуры кипения. Плотность алкинов меньше плотности воды.
3 .Строение ненасыщенных углеводородов:
Изобразим строение молекул этилена и ацетилена структурно. Если углерод считать четырехвалентным, то исходя из молекулярной формулы этилена, у него не все валентности востребованы, а у ацетилена лишними оказываются четыре связи. Изобразим структурные формулы этих молекул:

На образование двойной связи атом углерода затрачивает по два электрона, а на тройную связь по три электрона. В формуле это обозначается в виде двух или трех точек. Каждая черточка – это пара электронов.

электронная формула.
Экспериментально доказано, что в молекуле с двойной связью одна из них относительно легко разрывается, соответственно с тройной связью легко разрываются две связи. Мы можем продемонстрировать это на опыте.
Демонстрация опыта:
1.Смесь спирта с H2SO4 нагреваем в пробирке с песком. Газ пропускаем через раствор KMnO4, затем поджигаем.
Обесцвечивание раствора происходит по причине присоединения атомов по месту разрыва кратных связей.
3СН2=СН2+2КМnO4+4H2O → 2MnO2+3C2H4(OH)2+2KOH
Электроны, образующие кратные связи, в момент взаимодействия с КМnO4распариваются, образуются непарные электроны, легко вступающие во взаимосвязь с другими атомами с неспаренными электронами.
Этилен и ацетилен являются первыми в гомологических рядах алкенов и алкинов.
Этен. На плоской горизонтальной поверхности, которая демонстрирует плоскость перекрывания гибридных облаков (σ – связи) лежат 5 σ –связей. Перпендикулярно этой поверхности лежат Р –облака негибридные, они образуют одну π-связь.
Этин. В этой молекуле две π -связи, которые лежат в плоскости, перпендикулярной плоскости σ –связи и взаимно перпендикулярно друг другу. π-связи непрочные, т.к. имеют небольшую область перекрывания.
4. Изомерия алкенов и алкинов.
В ненасыщенных углеводородах кроме изомерии по углеродному скелету появляется новый вид изомерии - изомерия по положению кратной связи. Положения кратной связи указывается цифрой в конце названия углеводорода.
Например:
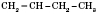 бутен-1;
бутен-1;
 бутин-2.
бутин-2.
Считают атомы Карбона с той стороны, к которой ближе кратная связь.
Например:
 4-метилпентен-1
4-метилпентен-1
Для алкенов и алкинов изомерия зависит от положения кратной связи и строения углеродной цепи. Поэтому в названии цифрой следует указать положение боковых цепей и положение кратной связи.
изомерия кратной связи: СН3—СН2—СН=СН2 СН3—СН=СН—СН3
бутен-1 бутен-2
Для непредельных углеводородов характерна пространственная или стереоизомерия. Она называется цис-, трансизомерией.
Подумайте, какое из этих соединений может иметь изомер.

Цистрансизомерия возникает только в случае, если каждый атом углерода при кратной связи соединен с разными атомами или группами атомов. Поэтому в молекуле хлорэтена (1) как бы мы не повернули атом хлора, молекула будет такой же. Другое дело в молекуле дихлорэтена (2), где положение атомов хлора относительно кратной связи может быть различным.
Физические свойства углеводорода зависят не только от количественного состава молекулы, но и от ее строения.
Так, цисизомер 2 – бутена имеет температуру плавления – 138ºС, а его трансизомер – 105,5ºС.
Этен и этин: промышленные способы их получения связаны с дегидрированием предельных углеводородов.

5 .Получение непредельных углеводородов:
1. Крекинг нефтепродуктов. В процессе термического крекинга предельных углеводородов наряду с образованием алканов происходит образование алкенов.

2. Дегидрирование предельных углеводородов. При пропускании алканов над катализатором при высокой температуре (400—600 °С) происходит отщепление молекулы водорода и образование алкена:
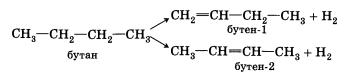
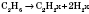

3.Дегидратация с пиртов (отщепление воды). Воздействие водоотнимающих средств (Н2804, Аl203) на одноатомные спирты при высокой температуре приводит к отщеплению молекулы воды и образованию двойной связи:

Эту реакцию называют внутримолекулярной дегидратацией (в отличие от межмолекулярной дегидратации, которая приводит к образованию простых эфиров)
4.Дегидрогалогенировани е (отщепление галогеноводорода).
При взаимодействии галогеналкана со щелочью в спиртовом растворе образуется двойная связь в результате отщепления молекулы галогеноводорода. Реакция идет в присутствии катализаторов (платины или никеля) и при нагревании. В зависимости от степени дегидрирования можно получить алкены или алкины, а также осуществить переход от алкенов к алкинов:

Обратите внимание, что в результате этой реакции образуется преимущественно бутен-2, а не бутен-1, что соответствует правилу Зайцева:Водород в реакциях разложения отщепляется от того атома Углерода, у которого наименьшее количество атомов Водорода:

(Водород отщепляется от  , но не от
, но не от 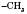 ).
).
5. Дегалогенирование. При действии цинка на дибромпроиз-водное алкана происходит отщепление атомов галогенов, находящихся при соседних атомах углерода, и образование двойной связи:

6. В промышленности ацетилен в основном получают термическим разложением метана:

6 .Химические свойства.
Химические свойства непредельных углеводородов связаны прежде всего с наличием π – связи в молекуле. Область перекрывания облаков в этой связи мала, поэтому она легко разрывается, а углеводороды насыщаются другими атомами. Для непредельных углеводородов характерны реакции присоединения.
Для этилена и его гомологов характерны реакции, идущие с разрывом одной из двойных соединений и присоединением атомов по месту разрыва, то есть реакции присоединения.
1 ) Горение (в достаточном количестве кислорода или воздуха):
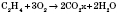
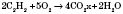
2) Гидрирование (присоединение водорода):
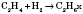


3) Галогенирование (присоединение галогенов):



4) Гидро галогенирование (присоединение галогеноводородов):