Выражения констант гидролиза для каждой ступени:
К Г1 = 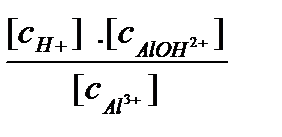 =
= 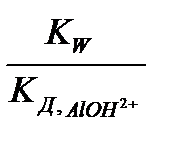 ;
;
К Г2 =  =
= 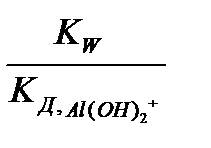 ;
;
К Г3 =  =
=  .
.
4. Рассчитайте водородный показатель рН раствора данного электролита при заданной молярной концентрации раствора соли С0, моль/л, учитывая только первую ступень гидролиза.
Расчет константы гидролиза соли по 1-ой ступени гидролиза:
К Г1 = 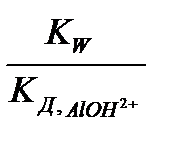 =
=  =10-14/1,38.10-9 = 7,25.10-6 .
=10-14/1,38.10-9 = 7,25.10-6 .
Значение К Д3, Al(OH)3 - по табл. 3.2. приложения.
В соответствии с уравнением диссоциации соли, концентрация иона Al 3+ в растворе: с Al 3+ = 2. с 0 = 2. 0,25 = 0,5 моль/л.
Степень гидролиза:
________ ___________
β =Ö КГ1 / с Al3+ = Ö7,25×10-6 /0,5 = 3,81 .10 -3.
Равновесная концентрация ионов H+ в растворе (по 1-ой ступени гидролиза):
[H+ ] = β . с Al 3+ = 3,81 .10 -3 . 0,5 = 1,91 .10 -3 моль/л.
Водородный показатель раствора:
рН = ‑ lg [H+ ] = ‑ lg 1,91 .10 -3 = 2,6 < 7, следовательно, раствор имеет кислую реакцию среды.
ЗАДАЧА 4. Малорастворимые растворы электролитов.
| Электролит | m, г |
| As2S3 | 0,3 |
Напишите выражение для произведения растворимости ПР малорастворимого электролита (п.4). Предложите методы осаждения из раствора данного малорастворимого электролита.
Соль As2S3 - сильный электролит, имеетсяполная диссоциация на ионы:
As2S3 → 2As 3+ + 3S 2-.
По табличным значениям (табл. 3.3. приложения) произведение растворимости соли ПР As2S3 = 3,8.10-29 - очень мало, следовательно, растворимость соли мала, поэтому активность ионов принимаем равной концентрации ионов аi ≈ сi.
Выражение для произведения растворимости ПР малорастворимого электролита As2S3:
ПР = (а As3+)2 . (а S2- )3 = (с As3+)2 . (с S2- )3.
2. По табличным значениям ПР рассчитайте предельную растворимость (С р, моль/л) для полученного малорастворимого электролита.
Концентрацию насыщенного раствора обозначим с р.
В соответствии с уравнением диссоциации концентрация ионов в насыщенном растворе: с As3+ = 2 с р , с As3+ = 3 с р.
Тогда ПР = (2 с р)2 . (3 с р)3 = 108 (с р)5.
Предельная растворимость полученного малорастворимого электролита:
5 _______ 5__________
с р = Ö ПР/108 = Ö3,8.10-29 /108 = 8,1.10-7 моль/л.
3. Рассчитайте, в каком объеме воды можно растворить заданную массу (m, г) полученного малорастворимого вещества.
Объем воды, в котором можно растворить заданную массу полученного малорастворимого вещества (m = 0,3 г):
V =  =
=  = 1,4.103 л,
= 1,4.103 л,
где М = 264 г/моль – молярная масса As2S3 .
Приложения
Табл. 3.1. Приближенные коэффициенты активности отдельных ионов
| ионы | Ионная сила раствора | ||||
| 0,001 | 0,005 | 0,01 | 0,05 | 0,1 | |
| водорода | 0,98 | 0,95 | 0,92 | 0,88 | 0,84 |
| однозарядные | 0,98 | 0,95 | 0,92 | 0,85 | 0,80 |
| двухзарядные | 0,77 | 0,65 | 0,58 | 0,40 | 0,30 |
| трехзарядные | 0,73 | 0,55 | 0,47 | 0,28 | 0,21 |
Табл. 3.2. Константы диссоциации некоторых слабых электролитов (Т =298 К)
| вещество | К Д | вещество | К Д |
| CH3COOH | К =1,75.10-5 | H2O | К =1,8.10-16 |
| HAlO2 | К =6,0.10-13 | NH4OH | К =1,8.10-5 |
| H3BO3 | К 1=5,8.10-10 К 2=1,8.10-13 К 3=1,6.10-14 | AgOH | К =1,1.10-4 |
| HCOOH | К =1,77.10-4 | Al(OH)3 | К 3=1,38.10-9 |
| HCN | К =7,9.10-10 | Cd(OH)2 | К 2=5,0.10-3 |
| H2CO3 | К 1=4,45.10-7 К 2=4,8.10-11 | Cu(OH)2 | К 2=3,4.10-7 |
| HF | К =6,61.10-4 | Cr(OH)3 | К 3=1,0.10-10 |
| H2Te | К 1=1,0.10-3 К 2=1,0.10-11 | Fe(OH)2 | К 2=1,3.10-4 |
| H2TeO3 | К 1=3,0.10-3 К 2=2,0.10-8 | Fe(OH)3 | К 2=1,8.10-11 К 3=1,3.10-12 |
| HNO2 | К =4,0.10-4 | Ni(OH)2 | К 2=2,5.10-5 |
| HOBr | К =2,1.10-9 | Pb(OH)2 | К 1=9,6.10-4 К 2=3,0.10-8 |
| HOCl | К =5,0.10-8 | Zn(OH)2 | К 1=4,4.10-5 К 2=1,5.10-9 |
| H3PO4 | К 1=7,5.10-3 К 2=6,31.10-8 К 3=1,3.10-12 | ||
| H2SO3 | К 1=1,7.10-2 К 2=6,3.10-8 | ||
| H2S | К 1=1,1.10-7 К 2=1,0.10-14 | ||
| H2SeO3 | К 1=3,5.10-3 К 2=5,0.10-8 | ||
| H2SiO3 | К 1=2,2.10-10 К 2=1,6.10-12 |
Табл. 3.3. Произведения растворимости некоторых малорастворимых в воде электролитов (Т =298 К)
| вещество | ПР | вещество | ПР |
| AgCl | 1,56.10-10 | CdS | 1,2.10-28 |
| AgBr | 4,4.10-13 | CuS | 4,0.10-38 |
| AgI | 9,7.10-17 | FeS | 3,7.10-19 |
| Ag2SO4 | 7,7.10-5 | MnS | 2,0.10-15 |
| Ag2S | 1, 6.10-49 | NiS | 1,1.10-27 |
| As2S3 | 3,8.10-29 | PbCl2 | 2,12.10-5 |
| BaCO3 | 8,1.10-9 | PbI2 | 9,8.10-9 |
| BaSO4 | 1,08.10-10 | PbSO4 | 1,6.10-8 |
| MgCO3 | 1,0.10-5 | PbS | 3,6.10-29 |
| Ca CO3 | 4,8.10-9 | ZnS | 7,4.10-27 |
| CaSO4 | 6,1.10-5 |