Энергия. Работа. Теплота. Теплоемкость.
Энергия - внутренняя, энтальпия, энергия Гиббса, энергия Гельмгольца.
Энергия - мера способности системы совершать работу.
Различают кинетическую энергию (энергию движения) и потенциальную энергию (энергию положения и взаимодействия частиц) системы.
Внутренняя энергия – энергия всех положений частиц системы.
РаботаА – любая макрофизическая форма передачи энергии, связанная с перемещением масс макроскопических размеров под действием каких-либо сил.
Теплота, количество теплоты —энергетическая характеристика процесса теплообмена, измеряемаяколичеством энергии, которое получает или отдает в этом процессетело или система. Единица измерения (в СИ- джоуль (Дж), но до настоящего времени мы пользуемся калориметрами.
Качественно и количественно иной формой передачи энергии является теплотаQ. Теплота – любая микрофизическая форма передачи энергии.
Для количественной оценки теплоты, которую получает телопри нагревании, вводится функция теплоемкость.
Теплоемкостью называется количество теплоты, соответствующееизменению температуры единицы количества вещества на1°С.
Количество теплоты, необходимое для нагревания 1 г веществана 1°С, называется удельной теплоемкостью.
Количество теплоты,необходимое для нагревания 1 моля вещества на 1°С называется молярной теплоемкостью.
Смол= Суд*М
изобарическая теплоемкость – Cp
изохорическая теплоемкость – Cv
Cp= Cv+R – формула Майера
Следует различать среднюю теплоемкость для интервала температури истинную при данной температуре, соответствующуюбесконечно малому приращению теплоты, деленному на бесконечномалое приращение температуры.
Истинная теплоемкость:

 Внутренняя энергия U =
Внутренняя энергия U =
Энтальпия H =

Термодинамически равновесное состояние характеризуется постоянством всех свойств во времени в любой точке системы и отсутствием потоков вещества и энергии в системе.Для выведения системы из этого состояния необходим обмен энергией или веществом между системой и окружающей средой.
Стационарное состояние системы характеризуется постоянством свойств во времени, которое поддерживается за счет непрерывного обмена веществом, энергией и информацией между системой и окружающей средой.
Важно различать состояния термодинамического равновесия и химического равновесия; последнее всегда имеет динамический характер, так как достигается в результате выравнивания скоростей обратимых процессов.
Законы термодинамики
Нулевой закон термодинамики
Все системы, находящиеся в тепловом равновесии друг с другом обладают общим свойством: они находятся при одной и той же температуре.
Часто процессы в т/д системе становятся необратимыми из-за того, что протекают процессы диффузии.
В термодинамике различают однородные и неоднородные системы, подразумевая под этим равномерное или неравномерное распределение свойств, температур и др.
Неоднородные системы не являются равновесными, в них возникают процессы диффузии и теплопередачи, то есть принципиально необратимые процессы.
Закон термодинамики
Впервые этот закон сформулирован в 1842 году Ю. Майером:
«Энергия не исчезает и не возникает из ничего, а только превращается из одного вида в другой в строго эквивалентных соотношениях». Эта формулировка может быть конкретизирована:
«В изолированной системе внутренняя энергия постоянна, т.е. ∆U = 0»;
«Если теплотаQподведена в закрытую систему, то эта энергия расходуется на увеличение внутренней энергии системы ∆Uи на совершение системой работы против внешних сил окружающей среды, или
в общем случае замкнутой системы обмен энергией с окружающей средой возможен,а энергия Q будет распределяться на повышение запасов внутренней энергии и работу А, которую система может совершать:

или для малых величин  .
.
В математическом выражении первого закона термодинамики энергия Q, полученная из окружающей среды имеет знак «+», а отданная в окружающую среду «-».
Приращение внутренней энергии имеет знак «+», уменьшение – «-».
А – внешняя работа, совершаемая системой «+», совершаемая над системой «-». Выразим это взаимодействие через характеристики ТС.
1) При изохорическом процессе (V=const)



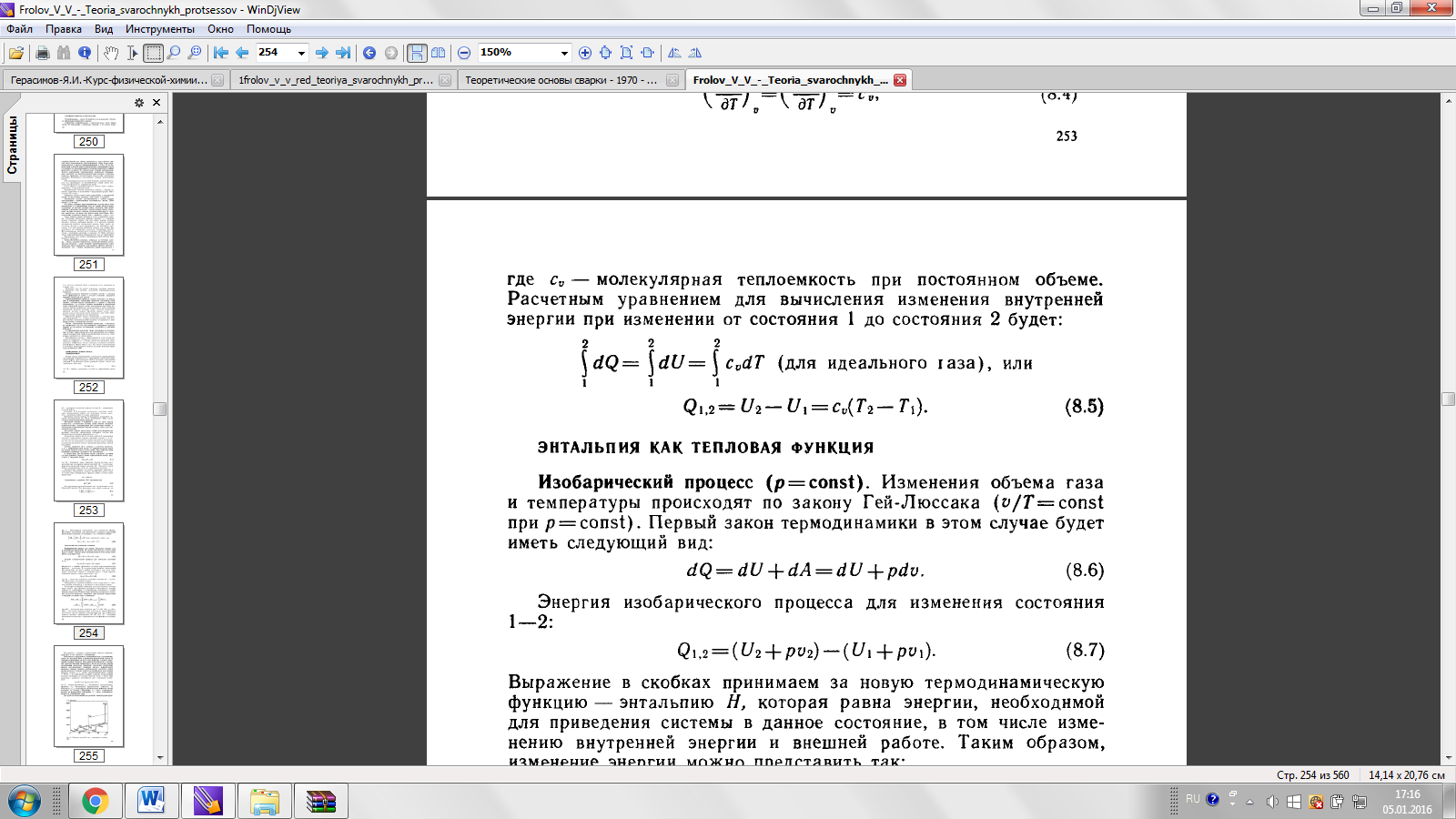
2) В изотермическом процессе (T=const)



3) Адиабатический процесс (δQ = 0)












4) P=const



В изобарно-изотермических условиях имеем:


Сумму внутренней энергии системы и произведения объема на давление (U+pV) называют энтальпией (H) или теплосодержанием.
Энтальпия - термодинамическая функция, характеризующая энергетическое состояние системы в изобарно-изотермических условиях.
Теплота, полученная системой при р,Т = const, равнаприращению энтальпии системы ∆H:
Q = Нкон- Ннач = ∆H
В условиях изобарно-изотермического процесса разность значений ∆H равна внутренней энергии и внешней работе, которая необходима для перевода системы из одного состояния в другое.
При разработке и реализации того или иного химического процесса приходится решать две крупные проблемы. Первая связана с возможностью протекания химической реакции при определенных условиях (Т, р и др) с целью получения желаемого продукта. Термодинамический подход указывает на принципиальную возможность самопроизвольного протекания реакции. Второй проблемой является скорость самопроизвольного процесса.

! 
При Т=0 ∆Н=∆Н0> 0.
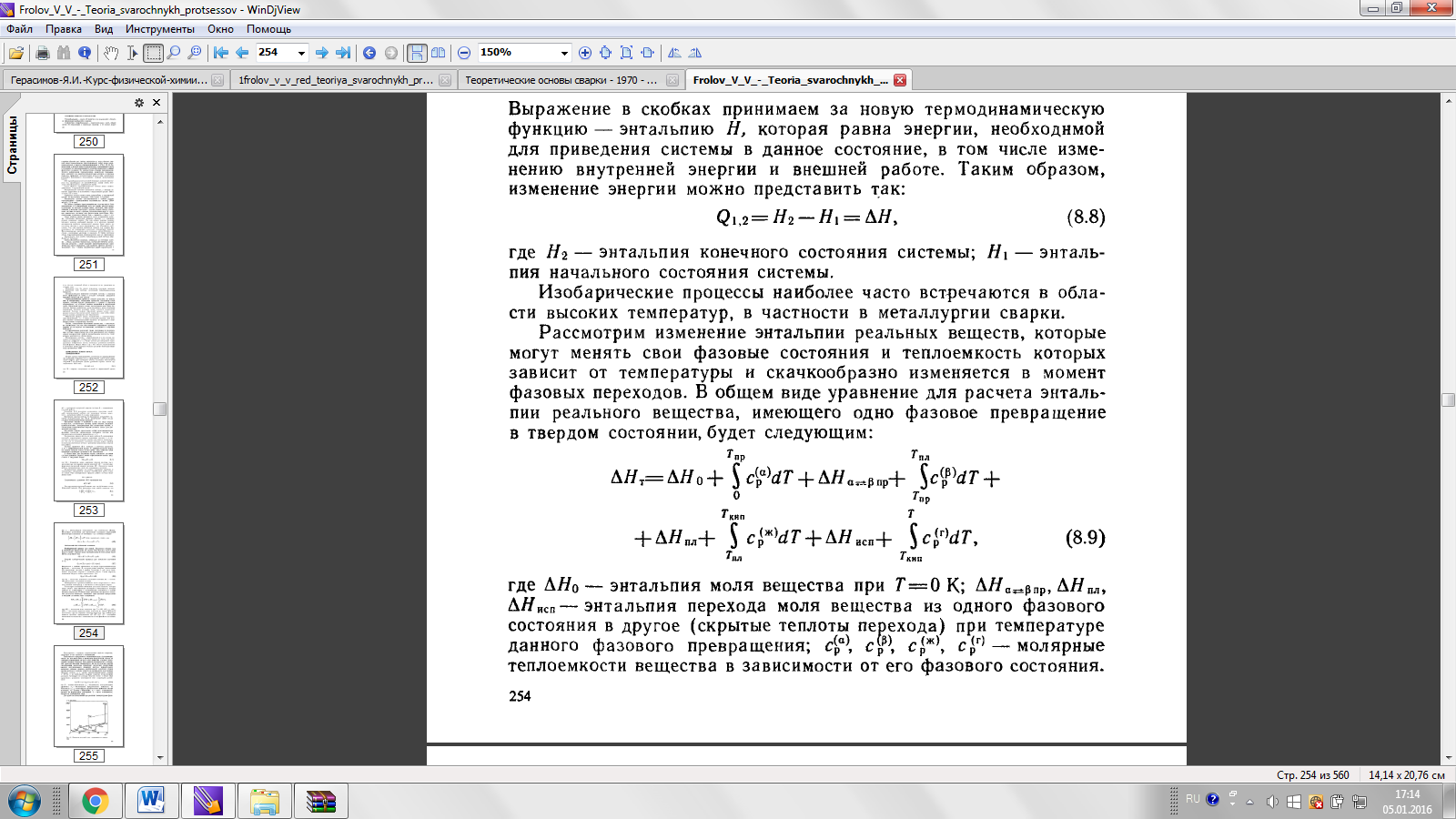
 - теплоемкости, рассчитанные на 1 моль вещества, зависимость от температуры которых меняется при переходе вещества из одного состояния в другое.
- теплоемкости, рассчитанные на 1 моль вещества, зависимость от температуры которых меняется при переходе вещества из одного состояния в другое.
При осуществлении разнообразных физико-химических процессов пользоваться абсолютными значениями энтальпий, вычисленных от 0К и неудобно, и ненужно: можно выбрать любой удобный уровень отсчета.Для удобства расчетов приняты стандартные условия: количество вещества - 1 моль;
температура - 298,16K=250C;
давление - 760 мм рт. ст. (1атм) = 191325 Па = 1,013*105Па;
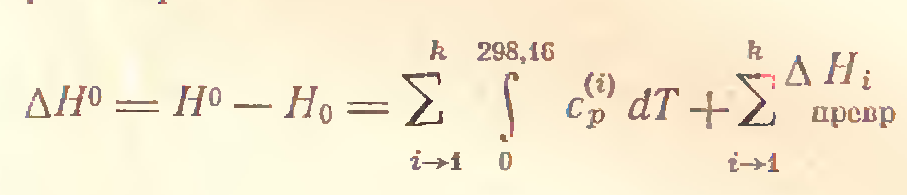
Для оценки энергетического состояния веществ используются значения стандартных энтальпий образования этих веществ, обозначаемые ∆Н0 (вещество(агрегатное состояние)), кДж/моль.