План.
1. Понятие о химической связи. Виды связи: ковалентная, ионная, металлическая. Свойства ковалентной связи: направленность, кратность, длина, полярность. Структурные и электронные формулы вещества.
2. Кристаллические решетки. Зависимость свойств веществ от типа кристаллической решетки и химической связи.
3. Окислительно-восстановительные процессы. Расстановка коэффициентов в ОВР.
4. Возможность самопроизвольного ОВ процесса. Гальванические элементы. Электролиз.
1. Только инертные газы в обычных условиях находятся в одноатомном состоянии, т.е. каждый атом – отдельно от других. Все остальные элементы, стремясь завершить свой внешний электронный слой, образуют химические связи. Это стремление иметь 8 электронов на внешнем слое называют правилом октета. Обычно, перед тем как вступить в химическую реакцию атом должен получить дополнительную энергию и перейти в возбужденное состояние.
 Химическая связь имеет электронную природу, т.е. образуется за счет взаимодействия между ядрами и электронами атомов. Существует несколько видов химической связи.
Химическая связь имеет электронную природу, т.е. образуется за счет взаимодействия между ядрами и электронами атомов. Существует несколько видов химической связи.
Самая распространенная - ковалентная связь образуется за счет общих электронных пар. Она характерна для неметаллов, т.е. элементов с высокой ЭО, которые завершают свой внешний электронный слой за счет чужих электронов. Обычно ковалентная связь образуется за счет неспаренных электронов внешнего электронного слоя.
Можно себе представить ковалентную связь как зону повышенной электронной плотности, которая возникает между ядрами двух атомов за счет перекрывания электронных облаков и притягивает эти ядра, образуя из отдельных частиц единое целое. Так перекрываются s и p орбитали в молекулах водорода Н2 и хлора Cl2
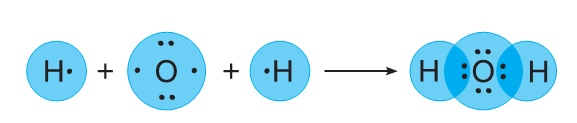


Возможно и перекрывание орбиталей s и p, например, в молекуле воды или хлороводорода. И во всех этих случаях область повышенной электронной плотности находится на прямой, которая соединяет центры атомов. Такую связь называют сигма-связь и обозначают буквой  . Такую связь обозначают в электронных формулах веществ двумя точками (пара электронов), а в структурных формулах – черточкой.
. Такую связь обозначают в электронных формулах веществ двумя точками (пара электронов), а в структурных формулах – черточкой.
Но если связь образована не одной парой электронов, а двумя, то две пары электронных облаков не могут перекрываться на одной прямой. Одна пара электронов перекрывается на прямой соединяющей центы атомов и образует  связь, а другая пара р-орбиталей, перекрывается своими боковыми сторонами и образует
связь, а другая пара р-орбиталей, перекрывается своими боковыми сторонами и образует  -связь. Область повышенной электронной плотности
-связь. Область повышенной электронной плотности  -связилежит вне прямой, соединяющей центры атомов.
-связилежит вне прямой, соединяющей центры атомов.


 Связь, образованная одной парой электронов, называется одинарной. Это всегда
Связь, образованная одной парой электронов, называется одинарной. Это всегда  связь.Она изображается двумя точками в электронной формуле и одной черточкой – в структурной формуле вещества. Связь, образованная двумя парами электронов, называется двойной связью и изображается в электронной формуле двумя парами электронов, а в структурной формуле двумя черточками. О=О. Одна из этих двух связей всегда
связь.Она изображается двумя точками в электронной формуле и одной черточкой – в структурной формуле вещества. Связь, образованная двумя парами электронов, называется двойной связью и изображается в электронной формуле двумя парами электронов, а в структурной формуле двумя черточками. О=О. Одна из этих двух связей всегда  , а другая -
, а другая -  .
.
 -связь менее прочная чем
-связь менее прочная чем  . Но она «жесткая», т.е. вокруг нее невозможно свободное вращение атомов, образующих связь.
. Но она «жесткая», т.е. вокруг нее невозможно свободное вращение атомов, образующих связь.
Если связь образована тремя парами электронов, то она будет называться тройной связью. Тройная связь всегда состоит из одной  -связи и двух π-связей. Например:
-связи и двух π-связей. Например:


 Структурную формулу азота поэтому изображают N≡N.
Структурную формулу азота поэтому изображают N≡N.
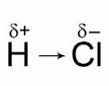
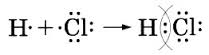 Различают ковалентную полярную связь и ковалентную неполярную связь (КП и КНП). Если атомы, образующие связь одинаковы, то электронная пара в равной степени принадлежит обоим атомам, и связь называют КНП. Если атомы разные, то электронная пара смещена к более ЭО атому, на атомах появляются частичные заряды, т.н. «полюса», и связь называется КП. Элемент с большей ЭО приобретает частичный отрицательный заряд, элемент с меньшей ЭО – частичный положительный заряд. Ковалентная неполярная связь характерна для простых веществ неметаллов, а полярная – для их соединений.
Различают ковалентную полярную связь и ковалентную неполярную связь (КП и КНП). Если атомы, образующие связь одинаковы, то электронная пара в равной степени принадлежит обоим атомам, и связь называют КНП. Если атомы разные, то электронная пара смещена к более ЭО атому, на атомах появляются частичные заряды, т.н. «полюса», и связь называется КП. Элемент с большей ЭО приобретает частичный отрицательный заряд, элемент с меньшей ЭО – частичный положительный заряд. Ковалентная неполярная связь характерна для простых веществ неметаллов, а полярная – для их соединений.
Ковалентная связь локализована в пространстве, у  нее есть длина, есть определенный угол между связями (валентный угол), ее прочность характеризуется энергией, которая необходима для разрыва связи. Чем больше разница в ЭО элементов, тем более полярной является ковалентная связь. КНП более прочная, чем КП.
нее есть длина, есть определенный угол между связями (валентный угол), ее прочность характеризуется энергией, которая необходима для разрыва связи. Чем больше разница в ЭО элементов, тем более полярной является ковалентная связь. КНП более прочная, чем КП.
 Если элементы очень сильно отличаются по ЭО, т.е. принадлежат один к металлам, другой к неметаллам, то электроны полностью переходят к более ЭО атому, образуются реальные заряды, и атомы превращаются в ионы, которые связаны электростатическим взаимодействием. Связь между ионами называют ионной. Такая связь характерна для сложных веществ, образованных металлами и неметаллами. Ионная связь связывает все отрицательные ионы и все положительные ионы в веществе, а не конкретные ионы. Такая связь называется нелокализованной. Ионная связь менее прочная чем КП.
Если элементы очень сильно отличаются по ЭО, т.е. принадлежат один к металлам, другой к неметаллам, то электроны полностью переходят к более ЭО атому, образуются реальные заряды, и атомы превращаются в ионы, которые связаны электростатическим взаимодействием. Связь между ионами называют ионной. Такая связь характерна для сложных веществ, образованных металлами и неметаллами. Ионная связь связывает все отрицательные ионы и все положительные ионы в веществе, а не конкретные ионы. Такая связь называется нелокализованной. Ионная связь менее прочная чем КП.
Связь и ковалентная, и ионная обычно образуется за счет неспаренных электронов. Такой механизм образования связи называют обменным. А ⍗+ В⍗ → А ↑↓ В
Но иногда реализуется донорно-акцепторный механизм образования связи. А↑↓ + В → А ↑↓ В
В роли донора электронной пары выступают обычно атомы неметаллов, а в роли акцептора – атомы водорода или металлов.
Разрыв связи может проходить тоже по двум вариантам
Гомолитический (или свободно-радикальный) А ↑↓ В →. А ⍗+ В⍗
Гетеролитический (или ионный) А ↑↓ В → [А↑↓]- + [В ]+
Первый способ разрыва характерен для неполярной связи и требует большой затраты энергии, а второй характерен для полярной связи, и происходит гораздо легче.
Простые вещества – металлы образуют особый вид химической связи, которую называют металлической. Она осуществляется валентными электронами, которые находятся в общем владении всех атомов металла (т.н. электронный газ). Металлическая связь неполярная и нелокализована в пространстве. Ее прочность сильно зависит от «плотности» электронного газа, т.е. от количества валентных электронов, которые участвуют в образовании связи. Например, у щелочных металлов она явно менее прочная, чем у переходных металлов.
2. Множество атомов соединяясь между собой образуют вещества. В твердом состоянии вещества могут иметь упорядоченную (кристаллическую) и неупорядоченную (аморфную) структуру. Модель кристаллического состояния вещества называют кристаллической решеткой. В зависимости от вида частиц, которые образуют кристаллическую решетку и типа химической связи в ней принято различать молекулярную, ионную, атомную и металлическую кристаллическую решетку.
Все металлы имеют металлическую решетку, в которой атом-ионы связаны между собой металлической связью. Это достаточно прочная связь. Все металлы – твердые вещества. (Ртуть исключение). Но прочность металлической связи колеблется в очень широких пределах. Поэтому температура плавления (температура при которой происходит разрыв связи и разрушение решетки) у металлов может быть от нескольких десятков – до нескольких тысяч градусов.
В ионной решетке ионы связаны между собой ионной связью. Это тоже достаточно прочная связь. Все вещества с ионной связью при н.у. – твердые. Прочность ионной связи зависит от размера ионов и их зарядов. Но чем полярнее связи между частицами, тем больше вероятность взаимодействия вещества с водой. Поэтому многие соединения с ионной связью хорошо растворимы в воде.
В атомной решетке атомы связаны между собой ковалентными связями. Неполярными или полярными. Ковалентная связь – самая прочная среди всех. Поэтому вещества с атомной решеткой имеют очень высокую температуру плавления и не растворяются в воде. Чем прочнее связь между частицами, тем выше температура плавления вещества, больше твердость.
В молекулярной решетке между молекулами не образуются химические связи. Конечно, молекулы могут взаимодействовать между собой, у них ведь есть и положительные ядра атомов, и их отрицательные электронные оболочки. Но эти взаимодействия (их называют Ван-дер-ваальсовыми) очень слабые, по сравнению с прочными химическими связями.




Водородная связь (Н-связь)– особый тип взаимодействия между частицами. В отличие от обычных химических связей, Н-связь (водородная связь) появляется не в результате целенаправленного синтеза, а возникает в подходящих условиях сама и проявляется в виде межмолекулярных или внутримолекулярных взаимодействий. 
Отличительная черта водородной связи – сравнительно низкая прочность. Ее энергия в 5–10 раз ниже, чем энергия химической связи. По энергии она занимает промежуточное положение между химическими связями и Ван-дер-ваальсовыми межмолекулярными взаимодействиями. В образовании Н-связи определяющую роль играет электроотрицательность участвующих в связи атомов – способность оттягивать на себя электроны химической связи от атома водорода – партнера, участвующего в этой связи. В результате на атоме А с повышенной электроотрицательностью возникает частичный отрицательный заряд d-, а на атоме водорода – положительный d+, химическая связь при этом поляризуется: Аd- – Нd+.
 Возникший частичный положительный заряд на атоме водорода позволяет ему притягивать другую молекулу, также содержащую электроотрицательный элемент атом В. Таким образом, основную долю в образование Н-связи вносят электростатические взаимодействия. В формировании Н-связи участвуют три атома, два электроотрицательных (А и Б) и находящийся между ними атом водорода Н, структура такой связи может быть представлена следующим образом: Б···Нd+–Аd- (водородную связь обычно обозначают точечной линией). Атом А, химически связанный с Н, называют донором протона (лат. donare – дарить, жертвовать), а Б – его акцептором (лат. acceptor – приемщик). Чаще всего истинного «донорства» нет, и Н остается химически связанным с А.
Возникший частичный положительный заряд на атоме водорода позволяет ему притягивать другую молекулу, также содержащую электроотрицательный элемент атом В. Таким образом, основную долю в образование Н-связи вносят электростатические взаимодействия. В формировании Н-связи участвуют три атома, два электроотрицательных (А и Б) и находящийся между ними атом водорода Н, структура такой связи может быть представлена следующим образом: Б···Нd+–Аd- (водородную связь обычно обозначают точечной линией). Атом А, химически связанный с Н, называют донором протона (лат. donare – дарить, жертвовать), а Б – его акцептором (лат. acceptor – приемщик). Чаще всего истинного «донорства» нет, и Н остается химически связанным с А.
 Атомов – доноров А, поставляющих Н для образования Н-связей, не много, практически всего три: N, O и F, в то же время набор атомов-акцепторов Б весьма широк. Само понятие и термин «водородная связь» ввели В.Латимер и Р.Родебуш в 1920, для того, чтобы объяснить высокие температуры кипения воды, спиртов, жидкого HF и некоторых других соединений. Сопоставляя температуры кипения родственных соединений Н2O, Н2S, Н2Se, и Н2Te, они обратили внимание на то, что первый член этого ряда – вода – кипит при температуре намного выше, чем это следовало из той закономерности, которую образовали остальные члены ряда. Из этой закономерности следовало, что вода должна кипеть на 200° С ниже, чем наблюдаемое истинное значение. Точно такое же отклонение наблюдается для аммиака в ряду родственных соединений: NН3, Н3P, Н3As. Его истинная температура кипения (–33° С) на 80° С выше ожидаемого значения. При кипении жидкости разрушаются только Ван-дер-Ваальсовы взаимодействия, те, что удерживают молекулы в жидкой фазе. Если температуры кипения неожиданно высокие, то, следовательно, молекулы связаны дополнительно еще какими-то силами. В данном случае это и есть водородные связи. Точно также повышенная температура кипения спиртов (в сравнении с соединениями, не содержащими группу -ОН) – результат образования водородных связей.
Атомов – доноров А, поставляющих Н для образования Н-связей, не много, практически всего три: N, O и F, в то же время набор атомов-акцепторов Б весьма широк. Само понятие и термин «водородная связь» ввели В.Латимер и Р.Родебуш в 1920, для того, чтобы объяснить высокие температуры кипения воды, спиртов, жидкого HF и некоторых других соединений. Сопоставляя температуры кипения родственных соединений Н2O, Н2S, Н2Se, и Н2Te, они обратили внимание на то, что первый член этого ряда – вода – кипит при температуре намного выше, чем это следовало из той закономерности, которую образовали остальные члены ряда. Из этой закономерности следовало, что вода должна кипеть на 200° С ниже, чем наблюдаемое истинное значение. Точно такое же отклонение наблюдается для аммиака в ряду родственных соединений: NН3, Н3P, Н3As. Его истинная температура кипения (–33° С) на 80° С выше ожидаемого значения. При кипении жидкости разрушаются только Ван-дер-Ваальсовы взаимодействия, те, что удерживают молекулы в жидкой фазе. Если температуры кипения неожиданно высокие, то, следовательно, молекулы связаны дополнительно еще какими-то силами. В данном случае это и есть водородные связи. Точно также повышенная температура кипения спиртов (в сравнении с соединениями, не содержащими группу -ОН) – результат образования водородных связей.
Водородная связь – глобальное явление, охватывающее всю химию. Помимо повышенной температуры кипения водородные связи проявляются себя также при формировании кристаллической структуры вещества, повышая его температуру плавления. В кристаллической структуре льда Н-связи образуют объемную сетку, при этом молекулы воды располагаются таким образом, чтобы атомы водорода одной молекулы были направлены к атомам кислорода соседних молекул. Водородные связи могут образовываться между частями одной молекулы (белки, нуклеиновые кислоты) определяя форму макромолекулы биополимера в пространстве.
3. Важной характеристикой вещества является степень окисления, в которой находятся его атомы. В предыдущей теме мы рассматривали понятие степени окисления, от чего зависит возможная величина степени окисления элемента и как ее определить по формуле бинарного соединения. Конечно, атомы имеют степени окисления не только в бинарных, но и в более сложных соединениях. Но их тоже можно вычислить, пользуясь алгоритмом.
Алгоритм вычисления степени окисления:
1) Обозначить известные с.о.
2) Обозначить за «Х» неизвестную с.о.
3) Составить уравнение, пользуясь правилом «Сумма степеней окисления всех атомов в сложном веществе равна нулю, а в ионе – заряду иона».
4) Решить уравнение
Рассмотрим применение этого алгоритма на простых примерах.
Пример 1. Укажите степени окисления всех атомов в молекуле H2SO4.
Решение. 1) Степени окисления водорода и кислорода уже известны: H(+1) и O(-2).
2) Неизвестную с.о. серы обозначаем – х.
3) Составляем уравнение для определения степени окисления серы: 2∙(+1) + х + 4∙(-2) = 0.
Решая данное уравнение, находим: х = +6. Ответ: H+2S+6O-24.
Пример 2. Рассчитайте степени окисления всех элементов в молекуле Al(NO3)3.
Решение. Алгоритм остается неизменным. В состав "молекулы" нитрата алюминия входит один атом Al(+3), 9 атомов кислорода (-2) и 3 атома азота, степень окисления которого нам и предстоит вычислить. Соответствующее уравнение: 1∙(+3) + 3х + 9∙(-2) = 0. Ответ: Al+3(N+5O-23)3.
Пример 3. Определите степени окисления всех элементов в (NH4)2SO4.
Решение. Степени окисления водорода и кислорода известны, серы и азота - нет. Классический пример задачи с двумя неизвестными! Будем рассматривать сульфат аммония не как единую "молекулу", а как объединение двух ионов: NH4+ и SO42-. Заряды ионов нам известны, в каждом из них содержится лишь один атом с неизвестной степенью окисления. Пользуясь опытом, приобретенным при решении предыдущих задач, легко находим степени окисления азота и серы. Ответ: (N-3H4+1)2S+6O4-2.
Вывод: если в молекуле содержится несколько атомов с неизвестными степенями окисления, попробуйте "разделить" молекулу на несколько частей.
Когда вещества вступают в химические реакции степени окисления элементов могут изменяться, потому что атомы могут терять или приобретать электрон. Окисление —это процесс, в котором элемент теряет свои электроны. Элемент, который теряет электроны и повышает степень окисления, называется восстановитель.
Если атом отдает свои электроны, то он приобретает положительный заряд: Zn0 -2e → Zn2+ Если отрицательно заряженный ион (заряд -1), например Сl-, отдает 1 электрон, то он становится нейтральным атомом или положительным ионом (сера): Cl- - 1e → Cl0 S-2 - 6 е → S+4
Если положительно заряженный ион или атом отдает электроны, то величина его положительного заряда увеличивается соответственно числу отданных электронов:
Fe2+ - 1e → Fe3+ S4+ - 2e→S2+ Mn2+ - 4e → Mn6+
Восстановление — это процесс, в котором элемент присоединяет электроны. Элемент, который присоединяет электроны и понижает степень окисления, называется окислителем.
Если атом присоединяет электроны, то он превращается в отрицательно заряженный ион:
S0 + 2e → S2- Br0 + 1e → Br-
Если положительно заряженный ион принимает электроны, то величина его заряда уменьшается:
S6+ + 2e → S4+ Mn7+ + 5e → Mn2+
или он может превратится в нейтральный атом:
H+ + 1e → H0 Al3+ + 3e → Al0.
Окислитель в процессе реакции восстанавливается, восстановитель — окисляется.
Окислительные и восстановительные свойства зависят от степени окисления в котором находится химический элемент. Рассмотрим эту зависимость на примере серы.
Сера теряет электроны, т.е. проявляет восстановительные свойства: S-2 → S0 → S+4 → S+6
Сера принимает электроны, т.е. проявляет окислительные свойства: S-2 ← S0 ← S+4 ← S+6
Поэтому S-2 не может принять электроны и быть окислителем, у нее только восстановительные свойства, а S+6 не может отдать электроны и быть восстановителем, у нее только окислительные свойства. В других степенях окисления сера может быть и окислителем, и восстановителем, в зависимости от того, с кем и при каких условиях она взаимодействует.
Следует помнить, что рассмотрение окисления (восстановления) как процесса отдачи (и принятия) электронов атомами или ионами не всегда отражает истинное положение, так как во многих случаях происходит не полный перенос электронов, а только смещение электронного облака от одного атома к другому. Именно поэтому мы говорим о степени окисления, т.е. условном заряде. Однако для составления уравнений окислительно-восстановительных реакций не имеет существенного значения, какая связь при этом образуется в соединении — ионная или ковалентная. И какой заряд будет: реальный на ионе или условный в молекуле. Поэтому для простоты будем говорить о присоединении или отдаче электронов независимо от типа связи.
Химические реакции, протекающие с изменением степени окисления элементов, входящих в состав реагирующих веществ, называются окислительно-восстановительными (ОВР).
Важным навыком в химии является умение расставлять коэффициенты в ОВР, потому что обычным подбором это сделать иногда очень трудно.