Весь процесс создания нового лекарственного соединения может быть разделен на 4 основных этапа:
1. поиск мишени действия нового лекарства;
2. поиск биологически активного вещества, обладающего нужным фармакологическим действием;
3. исследование этого соединения в эксперименте invitro и invivo;
4. получение разрешения Национальной администрации по лекарствам (FDA – в США, Фармкомитет – в России, и т.д.) и проведение испытаний в клинике.
Биоинформатика является базовой дисциплиной, прежде всего, при поиске мишеней действия новых лекарственных препаратов. В оценке перспективности конкретной мишени учитываются также возможности нахождения соответствующих лигандов (ингибиторов или активаторов). В процессе поиска базовых структур новых лигандов и на этапе оптимизации свойств веществ-кандидатов широко используются компьютерные методы.
Если 3D структура молекулы-мишени известна, то применяют так называемые прямые методы компьютерного конструирования лекарств. В структуре макромолекулы-мишени находят место связывания лиганда и проводят его анализ с помощью молекулярной графики (если имеется экспериментальная информация о месте связывания лиганда) или в комбинации с молекулярным докингом (нахождение места связывания путем молекулярного докинга известного лиганда с макромолекулой-мишенью). На основе полученных данных о структуре активного центра производят поиск новых лигандов в существующих компьютерных банках данных трехмерных структур малых молекул (рис.4).
Обязательным условием реализации подобного подхода является наличие рентгеноструктурных данных о трехмерном строении макромолекулы-мишени. Как правило подобную информацию получают из компьютерного банка PDB - Protein Data Bank, Brookhaven National Laboratory.
В качестве примера можно привести исследование, выполненное в НИИБМХ РАМН совместно с Центром молекулярного дизайна (Бельгия) по конструированию ингибиторов нейраминидазы вируса гриппа (рис.5). Целью данной работы был поиск новых базовых структур конкурентных ингибиторов нейраминидазы путем скрининга молекулярных баз данных, содержащих десятки тысяч низкомолекулярных коммерчески доступных соединений. Скрининг осуществлялся с помощью оригинальной программы DockSearch, разработанной в НИИ биомедхимии РАМН. Стратегия скрининга состояла из следующих этапов:
1. препроцессинг баз данных (предварительная селекция и подготовка данных);
2. молекулярно-графический анализ структур комплексов нейраминидазы с известными лигандами и описание места связывания лиганда в активном центре фермента;
3. генерация гипотез возможных комплексов нейраминидазы с каждой молекулой из банка данных с оценкой стерической комплементарности;
4. энергетическая оптимизация комплексов и выбор лучших комплексов по величине энергии связывания.
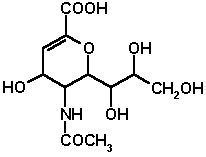
В результате поиска было найдено около 250 низкомолекулярных соединений, удовлетворяющих стерическим и энергетическим требованиям, которые были переданы в Центр молекулярного дизайна (Бельгия) для экспериментальной проверки. На рис. 5 показа структура активного центра нейраминидазы в комплексе с производным сиаловой кислоты - известным конкурентным ингибитором и одним из найденных новых перспективных лигандов.
В случае отсутствия данных о пространственной структуре макромолекулы-мишени или ее активного центра может быть построена соответствующая полная или частичная компьютерная трехмерная модель.
Моделирование взаимодействия лиганд-мишень 
Рис.4. Моделирование взаимодействия лиганд-мишень

 “L8”
“L8”
Рис. 5. Комплекс нейраминидазы вируса гриппа с известным ингибитором N-ацетил-2,3-дегидро-2-деоксинейраминовой кислотой (А) и найденным путем скрининга баз данных коммерчески доступных низкомолекулярных соединений новым лигандом «L8» (В).
Если информация о пространственной структуре белка-мишени и его ближайших гомологов отсутствует, но имеется статистически репрезентативная выборка специфических лигандов, поиск новых лигандов может быть осуществлен с использованием "непрямых" методов 3D QSAR и CoMFA(сравнительный анализ молекулярных полей). Эти методы могут быть успешно использованы для пространственного картирования места связывания лиганда и построения модели фармакофора. Построенная таким образом модель фармакофора в дальнейшем используется для скрининга потенциальных лигандов в банках данных низкомолекулярных органических соединений (database mining).
Заключение
Современная биоинформатика использует различные математические методы для моделирования процессов в живых системах и формализации механизмов, лежащих в основе биологических процессов. Имитационные модели позволяют на компьютерах моделировать и прогнозировать процессы в нелинейных сложных системах, каковыми являются все живые системы, далекие от термодинамического равновесия. На этих моделях изучаются принципиальные возможности пространственно-временной динамики поведения систем, их взаимодействия, изменения поведения систем при различных внешних воздействиях - случайных, периодических и т.п. Любая индивидуальная живая система требует глубокого и детального изучения, экспериментального наблюдения и построения своей собственной модели, сложность которой зависит от объекта и целей моделирования. Благодаря техническому прогрессу биоинформатика смогла далеко продвинуться вперед и во многом облегчить труд ученых со всего мира. Без компьютерных биоинформационных технологий развитие геномных исследований было бы невозможным. Компьютерный поиск генов особенно важен для исследования генома человека, так как методы классической генетики имеют ограниченное применение в этом случае - ведь человек, в отличие мух-дрозофил, не может быть объектом искусственного мутагенеза или иных генетических экспериментов.
Список литературы
1. Сетубал Ж, Мейданис Ж. "Введение в вычислительную молекулярную биологию". - М.-Ижевск: НИЦ "Регулярная и хаотичная динамика", 2007. - 420 с.
2. Арчаков А.И. Биоинформатика, геномика и протеомика науки о жизни XXI столетия//Вопр. мед. химии. 2000. No 1. С. 13 -18.
3. Баранов В.С. Молекулярная медицина – основа генной терапии//Мол. биол. 2000, Т. 34. No 4. С. 684 –695.
4. Белкина Н.В., Скворцов В.С., Иванов А.С., Арчаков А.И. Вопросы медицинской химии, 1998, 44, 464.
5. Киселев Л.Л. Геном человека и биология XXIвека//Вестн. РАН. 2000. Т. 70. No 5. С. 412 –424.
6. Сарвилина И.В., Каркищенко В.Н., ГоршковаЮ.В. Междисциплинарные исследования в медицине. –М.: Техносфера, 2007. –С. 15 –56.
7. Тарантул В.З. Геном человека: Энциклопедия, написанная четырьмя буквами. – М.: Языки слованской культуры, 2003. –392 с.
8. Дурбин Р, Эдди Ш, Крог А, Митчисон Г. «Анализ биологических последовательностей». — М.-Ижевск: НИЦ «Регулярная и хаотичная динамика», 2006. — 480 с.
9. А. Леск. Введение в биоинформатику. М., Бином, 2009.
10. С. Игнасимуту. Основы биоинформатики. М.-Ижевск, 2007.
11. Р. Дурбин, Ш. Эдди, А. Крог, Г. Митчисон. Анализ биологических последовательностей. М.-Ижевск, 2006.