Расчёт газобаллонной установки СУГ
Для газоснабжения жилого дома используется групповая баллонная установка, в которой применяются баллоны ёмкостью 50 л(d = 300 мм, H = 826 мм) с заполнением на высоту h = 600 мм.
Определить состав сжиженного газа, рассматривая его как смесь бутана и пропана, а также количество баллонов в установке, если температура наружного воздуха равна t 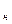 = 5 ˚C, давление газа в баллоне
= 5 ˚C, давление газа в баллоне 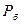 = 0,170МПа, перепад температур наружного воздуха и жидкой фазы составляет ∆t = 20˚C, коэффициент теплопередачи от воздуха к жидкой фазе принимается равным k = 9,6 Вт/(м
= 0,170МПа, перепад температур наружного воздуха и жидкой фазы составляет ∆t = 20˚C, коэффициент теплопередачи от воздуха к жидкой фазе принимается равным k = 9,6 Вт/(м 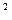 ∙К), а расчётный расход газа на все квартиры равен
∙К), а расчётный расход газа на все квартиры равен 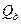 = 2,7 м
= 2,7 м 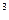 /ч.
/ч.
Решение
В соответствии с законом Рауля
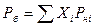
где  - мольная доля отдельных компонентов в жидкой фазе;
- мольная доля отдельных компонентов в жидкой фазе;
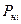 - упругость пара (давление насыщенного пара);
- упругость пара (давление насыщенного пара);
Так как ∆t = t 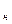 - t
- t 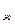 , находим температуру смеси
, находим температуру смеси
t 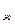 = t
= t 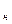 - ∆t, ˚C.
- ∆t, ˚C.
t 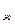 = 5-20 = -15 ˚C.
= 5-20 = -15 ˚C.
Из таблицы 13.2 [1] по t 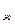 принимаем
принимаем 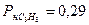 МПа (пропан),
МПа (пропан),
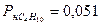 МПа (бутан).
МПа (бутан).
Скрытая теплота испарения пропана 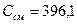 кДж/кг.
кДж/кг.
Скрытая теплота испарения бутана 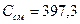 кДж/кг.
кДж/кг.
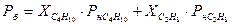 ;
;
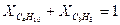 ;
;
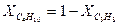 ;
;
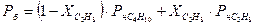 ;
;
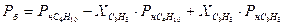 ;
;
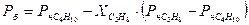
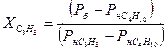 .
.
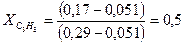 ;
;
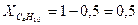 .
.
 ;
;
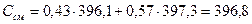 кДж/кг.
кДж/кг.
Пересчет состава смесей выполняем, используя формулы таблицы 13.5[1].
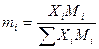 ;
;
где 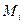 - мольная масса вещества.
- мольная масса вещества.
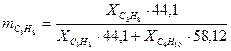
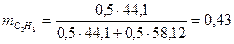
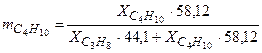
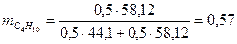
 .
.
Количество теплоты, поступающее газу из окружающей среды, определяется по формуле:
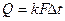 ,
,
где k -коэффициент теплопередачи от воздуха к жидкой фазе, Вт/(м 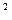 ·К);
·К);
F – смоченная поверхность теплообмена, м 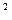 ;
;
∆t - перепад температур наружного воздуха и жидкой фазы, ˚C.
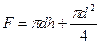 .
.
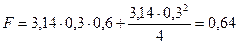 м2.
м2.
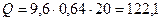 Вт.
Вт.
Производительность одного баллона определяется по формуле:
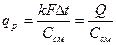
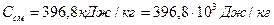
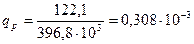 кг/с.
кг/с.
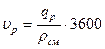
где 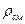 - плотность паровой фазы при нормальных условиях.
- плотность паровой фазы при нормальных условиях.
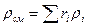 ,
,
где 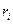 - объемные доли отдельных компонентов в паровой фазе.
- объемные доли отдельных компонентов в паровой фазе.
По закону Дальтона:
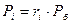 ,
,
где 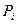 - парциальное давление.
- парциальное давление.
По закону Рауля:
 ,
,
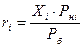 ,
,
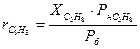 .
.
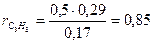 .
.
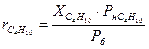
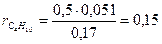
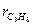 +
+ 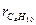 =1
=1
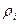 - плотность отдельных компонентов при нормальных условиях, кг/м3, определяемая по таблице 1.2 [1].
- плотность отдельных компонентов при нормальных условиях, кг/м3, определяемая по таблице 1.2 [1].
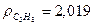 кг/м3;
кг/м3;
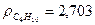 кг/м3.
кг/м3.
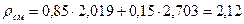 кг/м3;
кг/м3;
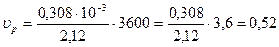 м3/ч.
м3/ч.
Количество баллонов в установке определяем по формуле:
N 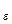 =
= 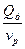 .
.
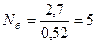 баллонов.
баллонов.
К установке принимаем количество баллонов, равное 2· N  , т. е. 10 баллонов.
, т. е. 10 баллонов.
Расчёт параметров газа и объёмов продуктов сгорания
По составу газа вычислить:
а) низшую и высшую теплоту сгорания;
б) плотность газа при нормальных условиях и при давлении P = 0,5 МПа и температуре t  = 35 ˚C;
= 35 ˚C;
в) теоретический и действительные объёмы образующихся продуктов горения - CO 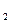 , H
, H 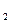 O, N
O, N 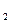 , O
, O 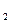 и суммарные объёмы продуктов горения;
и суммарные объёмы продуктов горения;
г) плотность продуктов сгорания при нормальных условиях и заданном коэффициенте расхода воздуха α = 2,5;
д) пределы воспламенения газа.
Вуктыльское месторождение газа. Состав газа в % объема:
СН4=89,62; С2Н6=5,92; С3Н8=2,36; С4Н10=0,86; С5Н12=0,22; СО2=0,9; N2=0,12.
| Газ | Химическая формула | Состав газа в % к объёму | Теплота сгорания, кДж/м 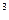
| Плотность,
кг/ м 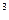
| |
| низшая | высшая | ||||
| Метан | CH 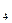
| 89,62 | 0,7168 | ||
| Этан | C 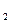 H H 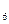
| 5,92 | 1,3566 | ||
| Пропан | C 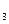 H H 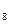
| 2,36 | 2,019 | ||
| Н-бутан | C 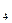 H H 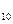
| 0,86 | 2,703 | ||
| Пентан | C 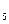 H H 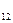
| 0,22 | 3,221 | ||
| Оксид углерода | CO 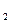
| 0,9 | - | - | 1,9768 |
| Азот | N 
| 0,12 | - | - | 1,2505 |
Решение
а) Теплота сгорания газообразного топлива может быть определена по следующим формулам:
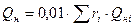 ,
,
где r  - процентное содержание горючей компоненты;
- процентное содержание горючей компоненты;
Q 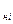 - низшая теплота сгорания отдельной компоненты, кДж/м
- низшая теплота сгорания отдельной компоненты, кДж/м  , принимается по справочникам, таблица 1.3 [1].
, принимается по справочникам, таблица 1.3 [1].
Высшая теплота сгорания:
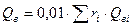 .
.
где Q 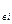 - высшая теплота сгорания отдельной компоненты, кДж/м
- высшая теплота сгорания отдельной компоненты, кДж/м 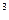 , принимается по справочникам, таблица 1.3 [1].
, принимается по справочникам, таблица 1.3 [1].
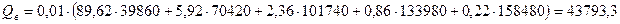 кДж/м
кДж/м 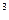 .
.
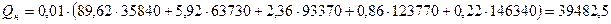 кДж/м
кДж/м  .
.
Углеродное числоn можно определить экспериментально или посчитать по формуле:
n = 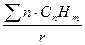 =
= 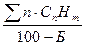 ,
,
где Б – балласт (CO 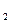 и N
и N 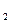 ).
).
n = 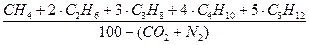
n = 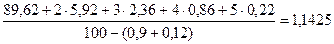
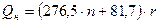 .
.
 .
.
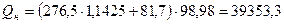 кДж/м
кДж/м  .
.
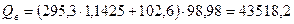 кДж/м
кДж/м  .
.
б) Плотность газообразного топлива при нормальных условиях определяется по формуле:
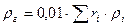 ,
,
где r  - процентное содержание отдельных компонент в топливе;
- процентное содержание отдельных компонент в топливе;
ρ  - плотность отдельных компонент при нормальных условиях, кг/м
- плотность отдельных компонент при нормальных условиях, кг/м  , принимаем по таблице 1.2 [1].
, принимаем по таблице 1.2 [1].
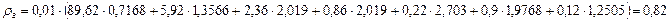 кг/м
кг/м  .
.
Плотность газообразного топлива при нормальных условиях может быть также определена по углеродному числу по формуле:
ρ  = (0,625· n + 0,089)·
= (0,625· n + 0,089)·  + 0,0125· N
+ 0,0125· N  + 0,0198· CO
+ 0,0198· CO 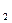 .
.
Плотность газа при рабочих условиях может быть определена по формуле:
ρ 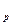 = ρ
= ρ  ·
· 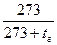 ·
· 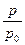 ,
,
где p – абсолютное давление газа, МПа;
p 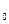 - давление газа при нормальных условиях, равное 0,1 МПа.
- давление газа при нормальных условиях, равное 0,1 МПа.
ρ 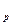 = 0,82
= 0,82 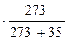 ·
· 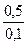 = 3,63 кг/м
= 3,63 кг/м  .
.
в) теоретический объём посчитан при α = 1,0, а действительный – при заданном α = 2,5.
- теоретически необходимое количество воздуха
V 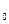 = 0,0476·[Σ(m + 0,25· n)· C
= 0,0476·[Σ(m + 0,25· n)· C 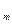 H
H 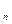 + 0,5· CO + 1,5· H
+ 0,5· CO + 1,5· H 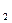 S + 0,5· H
S + 0,5· H 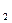 - O
- O 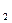 ];
];
V 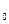 = = 0,0476· [2·89,62 + 4·5,92 + 5·2,36+6,5·0,86+8·0,22] = 10,43 м
= = 0,0476· [2·89,62 + 4·5,92 + 5·2,36+6,5·0,86+8·0,22] = 10,43 м  /м
/м  ;
;
- объёмдиоксидауглерода
V 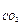 = 0,01·(Σ m ·C
= 0,01·(Σ m ·C 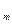 H
H 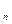 + CO
+ CO 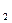 );
);
V 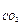 = 0,01·(1·89,62 + 2·5,92 + 3·2,36+4·0,86+5·0,22+0,9) = 1,14 м
= 0,01·(1·89,62 + 2·5,92 + 3·2,36+4·0,86+5·0,22+0,9) = 1,14 м  /м
/м  ;
;
- объёмазота
V 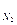 = 0,79· α · V
= 0,79· α · V 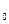 +0,01· N
+0,01· N 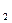 ;
;
V 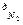 = 0,79·2,5·10,43+0,01·0,12 = 20,6 м
= 0,79·2,5·10,43+0,01·0,12 = 20,6 м  /м
/м  ;
;
V 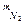 = 0,79·1,0·10,43+0,01·0,12 = 8,2 м
= 0,79·1,0·10,43+0,01·0,12 = 8,2 м  /м
/м  ;
;
- объём водяных паров
V 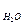 = 0,01·(Σ
= 0,01·(Σ 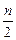 C
C 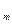 H
H 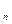 + 0,5· H
+ 0,5· H 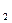 S +0,124· d +1,61· α · V
S +0,124· d +1,61· α · V 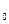 );
);
где d – влагосодержание природного газа, г/кг, принимаем d = 10,1 г/кг;
V 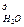 = 0,01·(2·89,62+3·5,92+4·2,36+5·0,86+6·0,22+0,124·10,1+1,61·2,5·10,43) = 2,55 м
= 0,01·(2·89,62+3·5,92+4·2,36+5·0,86+6·0,22+0,124·10,1+1,61·2,5·10,43) = 2,55 м  /м
/м  ;
;
V 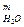 =0,01·(2·89,62+3·5,92+4·2,36+5·0,86+6·0,22+0,124·10,1+1,61·1,0·10,43) = 2,30 м
=0,01·(2·89,62+3·5,92+4·2,36+5·0,86+6·0,22+0,124·10,1+1,61·1,0·10,43) = 2,30 м  /м
/м  ;
;
- объём избыточного кислорода
V 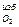 = 0,21·(α – 1)· V
= 0,21·(α – 1)· V 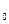
V 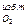 = 0,21·(1,0 – 1)·10,43 = 0;
= 0,21·(1,0 – 1)·10,43 = 0;
V 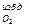 = 0,21·(2,5 – 1)·10,43 = 3,29 м
= 0,21·(2,5 – 1)·10,43 = 3,29 м  /м
/м  ;
;
- суммарный объём продуктов сгорания
V 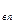 = V
= V 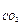 + V
+ V 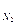 + V
+ V 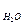 + V
+ V 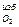 ;
;
V 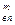 = 1,14 + 8,2 + 2,3 + 0 = 11,68 м
= 1,14 + 8,2 + 2,3 + 0 = 11,68 м  /м
/м  ;
;
V 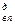 = 1,14 + 20,6 + 2,55 + 3,29 = 27,58 м
= 1,14 + 20,6 + 2,55 + 3,29 = 27,58 м  /м
/м  .
.
г) плотность продуктов сгорания при нормальных условиях определяется по формуле:
ρ 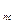 = 0,768
= 0,768 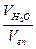 +1,429
+1,429 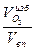 +1,2505
+1,2505 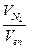 +1,9768
+1,9768 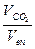
ρ 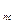 = 0,768
= 0,768  +1,429
+1,429 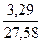 +1,2505
+1,2505 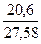 +1,9768
+1,9768 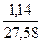 =1,26 кг/м3
=1,26 кг/м3
д) если газ забалластирован (содержание балласта превышает 5%), то в начале выполняют пересчет состава топлива, умножая процентное содержание горючих компонент на поправочный коэффициент, определяемый по формуле:
k = 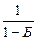 ,
, 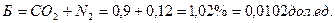
где Б – содержание балласта в долях единицы.
k = 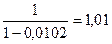
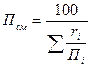 ,
,
где 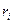 - процентное содержание горючих компонентов;
- процентное содержание горючих компонентов;
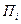 - предел воспламенения газа, принимаемый по таблице 17.2[1].
- предел воспламенения газа, принимаемый по таблице 17.2[1].
- верхний предел воспламенения
П 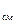 =
= 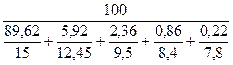 = 14,64 %;
= 14,64 %;
- нижний предел воспламенения
П 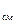 =
= 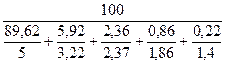 = 4,68 %;
= 4,68 %;