Дата: 28.10.2021 (1 час)
Цель:
дать понятие о дисперсных системах, их классификация. Раскрыть значение коллоидных систем в жизни природы и общества. Показать относительность деления растворов на истинные и коллоидные.
Студенты должны знать: понятия «суспензии», «эмульсии», «аэрозоли», «коллоидные растворы», «истинные растворы»; классификацию дисперсных систем по степени дисперсности и агрегатному состоянию.
Студенты должны уметь: приводить примеры дисперсных систем, характеризовать их свойства, сравнивать по структуре, объяснять причины большей или меньшей устойчивости.
План.
1. Дисперсные системы.
2. Классификация дисперсных систем.
3. Грубодисперсные системы:
· Взвеси (Эмульсии. Суспензии. Аэрозоли)
4. Тонкодисперсные системы:
· Коллоидные системы (Золи. Гели)
Опорный конспект
Дисперсные системы
Можно изучать каждую дисперсную систему по отдельности, но лучше их классифицировать, выделить общее, типичное и это запомнить. Для этого нужно определить, по каким признакам это сделать. Найдите в тексте, предложенный Вам для изучения признак классификации, изучите его. Создайте кластер, указав признаки и свойства дисперсных систем, приведите к нему примеры.
Чистые вещества в природе встречаются очень редко. Кристаллы чистых веществ – сахара или поваренной соли, например, можно получить разного размера – крупные и мелкие. Каков бы ни был размер кристаллов, все они имеют одинаковую для данного вещество внутреннюю структуру – молекулярную или ионную кристаллическую решетку.
В природе чаще всего встречаются смеси различных веществ. Смеси разных веществ в различных агрегатных состояниях могут образовывать гетерогенные и гомогенные системы. Такие системы мы будем называть дисперсными.
|
|
Дисперсной называется система, состоящая из двух или более веществ, причем одно из них в виде очень маленьких частиц равномерно распределено в объеме другого.
Вещество распадается на ионы, молекулы, атомы, значит “дробится” на мельчайшие частицы. “Дробление” диспергирование, т.е. вещества диспергируют до разных размеров частиц видимых и невидимых.
Вещество, которое присутствует в меньшем количестве, диспергирует и распределено в объеме другого, называют дисперсной фазой. Она может состоять из нескольких веществ.
Вещество, присутствующее в большем количестве, в объеме которого распределена дисперсная фаза, называют дисперсной средой. Между ней и частицами дисперсной фазы существует поверхность раздела, поэтому дисперсные системы называются гетерогенными (неоднородными).
И дисперсную среду, и дисперсную фазу могут представлять вещества, находящиеся в различных агрегатных состояниях – твердом, жидком и газообразном.
В зависимости от сочетания агрегатного состояния дисперсной среды и дисперсной фазы можно выделить 9 видов таких систем.
Таблица «Примеры дисперсных систем»
| Дисперсионная среда | Дисперсная фаза | Примеры некоторых природных и бытовых дисперсных систем |
| Газ | Газ | Всегда гомогенная смесь (воздух, природный газ) |
| Жидкость | Туман, попутный газ с капельками нефти, карбюраторная смесь в двигателях автомобилей (капельки бензина в воздухе), аэрозоли | |
| Твердое вещество | Пыли в воздухе, дымы, смог, самумы (пыльные и песчаные бури), аэрозоли | |
| Жидкость | Газ | Шипучие напитки, пены |
| Жидкость | Эмульсии. Жидкие среды организма (плазма крови, лимфа, пищеварительные соки), жидкое содержимое клеток (цитоплазма, кариоплазма) | |
| Твердое вещество | Золи, гели, пасты (кисели, студни, клеи). Речной и морской ил, взвешенные в воде; строительные растворы | |
| Твердое вещество | Газ | Снежный наст с пузырьками воздуха в нем, почва, текстильные ткани, кирпич и керамика, поролон, пористый шоколад, порошки |
| Жидкость | Влажная почва, медицинские и косметические средства (мази, тушь, помада и т. д.) | |
| Твердое вещество | Горные породы, цветные стекла, некоторые сплавы |
Классификация дисперсных систем
|
|
По величине частиц веществ, составляющих дисперсную фазу, дисперсные системы делятся на грубодисперсные (взвеси) с размерами частиц более 100 нм и тонкодисперсные (коллоидные растворы или коллоидные системы) с размерами частиц от 100 до 1 нм. Если же вещество раздроблено до молекул или ионов размером менее 1 нм, образуется гомогенная система – раствор. Она однородна, поверхности раздела между частицами и средой нет.
Дисперсные системы и растворы очень важны в повседневной жизни и в природе. Судите сами: без нильского ила не состоялась бы великая цивилизация Древнего Египта; без воды, воздуха, горных пород и минералов вообще бы не существовала живая планета – наш общий дом – Земля; без клеток не было бы живых организмов и т.д.
Грубодисперсные системы
Взвеси
Взвеси – это дисперсные системы, в которых размер частицы фазы более 100 нм. Это непрозрачные системы, отдельные частицы которых можно заметить невооруженным глазом. Дисперсная фаза и дисперсная среда легко разделяются отстаиванием, фильтрованием. Такие системы разделяются на:
|
|
1. Эмульсии ( и среда, и фаза – нерастворимые друг в друге жидкости). Из воды и масла можно приготовить эмульсию длительным встряхиванием смеси. Это хорошо известные вам молоко, лимфа, водоэмульсионные краски и т.д.
2. Суспензии (среда – жидкость, фаза – нерастворимое в ней твердое вещество). Чтобы приготовить суспензию, надо вещество измельчить до тонкого порошка, высыпать в жидкость и хорошо взболтать. Со временем частица выпадут на дно сосуда. Очевидно, чем меньше частицы, тем дольше будет сохраняться суспензия. Это строительные растворы, взвешенный в воде речной и морской ил, живая взвесь микроскопических живых организмов в морской воде – планктон, которым питаются гиганты – киты, и т.д.
3. Аэрозоли взвеси в газе (например, в воздухе) мелких частиц жидкостей или твердых веществ. Различаются пыли, дымы, туманы. Первые два вида аэрозолей представляют собой взвеси твердых частиц в газе (более крупные частицы в пылях), последний – взвесь капелек жидкости в газе. Например: туман, грозовые тучи – взвесь в воздухе капелек воды, дым – мелких твердых частиц. А смог, висящий над крупнейшими городами мира, также аэрозоль с твердой и жидкой дисперсной фазой. Жители населенных пунктов вблизи цементных заводов страдают от всегда висящей в воздухе тончайшей цементной пыли, образующейся при размоле цементного сырья и продукта его обжига – клинкера. Дым заводских труб, смоги, мельчайшие капельки слюны, вылетающих изо рта больного гриппом, также вредные аэрозоли. Аэрозоли играют важную роль в природе, быту и производственной деятельности человека. Скопление облаков, обработка полей химикатами, нанесение лакокрасочных покрытий при помощи пульверизатора, лечение дыхательных путей (ингаляция) – примеры тех явлений и процессов, где аэрозоли приносят пользу. Аэрозоли – туманы над морским прибоем, вблизи водопадов и фонтанов, возникающая в них радуга доставляет человеку радость, эстетическое удовольствие.
Для химии наибольшее значение имеют дисперсные системы, в которых средой является вода и жидкие растворы.
Природная вода всегда содержит растворенные вещества. Природные водные растворы участвуют в процессах почвообразования и снабжают растения питательными веществами. Сложные процессы жизнедеятельности, происходящие в организмах человека и животных, также протекают в растворах. Многие технологические процессы в химической и других отраслях промышленности, например, получение кислот, металлов, бумаги, соды, удобрений, протекают в растворах.
Тонкодисперсные системы
Коллоидные системы
Коллоидные системы (в переводе с греческого “колла” – клей, “еидос” вид клееподобные) – это такие дисперсные системы, в которых размер частиц фазы от 100 до 1 нм. Эти частицы не видны невооруженным глазом, и дисперсная фаза и дисперсная среда в таких системах отстаиванием разделяются с трудом.
Из курса общей биологии вам известно, что частицы такого размера можно обнаружить при помощи ультрамикроскопа, в котором используется принцип рассеивания света. Благодаря этому коллоидная частица в нем кажется яркой точкой на темном фоне.
Их подразделят на золи (коллоидные растворы) и гели (студни).
1. Коллоидные растворы, или золи. Это большинство жидкостей живой клетки (цитоплазма, ядерный сок – кариоплазма, содержимое органоидов и вакуолей). И живого организма в целом (кровь, лимфа, тканевая жидкость, пищеварительные соки и т.д.) Такие системы образуют клеи, крахмал, белки, некоторые полимеры.
Коллоидные растворы могут быть получены в результате химических реакций; например, при взаимодействии растворов силикатов калия или натрия (“растворимого стекла”) с растворами кислот образуется коллоидный раствор кремниевой кислоты. Золь образуется и при гидролизе хлорида железа (III) в горячей воде.
Характерное свойство коллоидных растворов – их прозрачность. Коллоидные растворы внешне похожи на истинные растворы. Их отличают от последних по образующейся “светящейся дорожке” – конусу при пропускании через них луча света. Это явление называют эффектом Тиндаля. Более крупные, чем в истинном растворе, частицы дисперсной фазы золя отражают свет от своей поверхности, и наблюдатель видит в сосуде с коллоидным раствором светящийся конус. В истинном растворе он не образуется. Аналогичный эффект, но только для аэрозольного, а не жидкого коллоида, вы можете наблюдать в лесу и в кинотеатрах при прохождении луча света от киноаппарата через воздух кинозала.
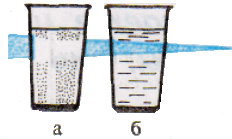
Пропускание луча света через растворы;
а – истинный раствор хлорида натрия;
б – коллоидный раствор гидроксида железа (III).
Частицы дисперсной фазы коллоидных растворов нередко не оседают даже при длительном хранении из-за непрерывных соударений с молекулами растворителя за счет теплового движения. Они не слипаются и при сближении друг с другом из-за наличия на их поверхности одноименных электрических зарядов. Это объясняется тем, что вещества в коллоидном, т.е., в мелкораздробленном, состоянии обладают большой поверхностью. На этой поверхности адсорбируются либо положительно, либо отрицательно заряженные ионы. Например, кремниевая кислота адсорбирует отрицательные ионы SiO32-, которых в растворе много вследствие диссоциации силиката натрия:
Частицы же с одноименными зарядами взаимно отталкиваются и поэтому не слипаются.
Но при определенных условиях может происходить процесс коагуляции. При кипячении некоторых коллоидных растворов происходит десорбция заряженных ионов, т.е. коллоидные частицы теряют заряд. Начинают укрупняться и оседают. Тоже самое наблюдается при приливании какого-либо электролита. В этом случае коллоидная частица притягивает к себе противоположно заряженный ион и ее заряд нейтрализуется.
Коагуляция – явление слипания коллоидных частиц и выпадения их в осадок – наблюдается при нейтрализации зарядов этих частиц, когда в коллоидный раствор добавляют электролит. При этом раствор превращается в суспензию или гель. Некоторые органические коллоиды коагулируют при нагревании (клей, яичный белок) или при изменении кислотно-щелочной среды раствора.
2. Гели или студни представляют собой студенистые осадки, образующиеся при коагуляции золей. К ним относят большое количество полимерных гелей, столь хорошо известные вам кондитерские, косметические и медицинские гели (желатин, холодец, мармелад, торт “Птичье молоко”) и конечно же бесконечное множество природных гелей: минералы (опал), тела медуз, хрящи, сухожилия, волосы, мышечная и нервная ткани и т.д. Историю развития на Земле можно одновременно считать историей эволюции коллоидного состояния вещества. Со временем структура гелей нарушается (отслаивается) – из них выделяется вода. Это явление называют синерезисом.
Вопросы для самоконтроля
1. Охарактеризуйте понятие «дисперсная система». Чем дисперсная система отличается от других смесей?
2. Какие типы дисперсных систем в зависимости от агрегатного состояния среды и фазы вы знаете? Приведите примеры
3. Какие системы называются грубодисперсными?
4. Какие системы называются тонкодисперсными?
5. Что такое гели, золи?
Критерии оценивания.
Оценка «отлично» - выполнены все задания правильно.
Оценка «хорошо» - выполнены 4 задания правильно.
Оценка «удовлетворительно» - выполнены 3 задания с негрубыми ошибками или 2 задания правильно.
Оценка «неудовлетворительно» - выполнено1 задание или нет ответа.
Уважаемые студенты, практическое задание необходимо выполнить в рабочей тетради (сфотографировать) или в формате Документа Word. Отправлять для проверки в личные сообщения на страницу ВКонтакте: https://vk.com/id343837166 Преподаватель: Острик Марина Григорьевна