Лабораторная работа №1
Цель: изучить основные методы и виды стерилизации, а так же области их применения. Произвести стерилизацию питательной среды и сделать вывод.
Материалы и оборудование: дрожжевая суспензия, камера Горяева, микроскоп, краситель, сухожаровой шкаф, чашки Петри со средой Сабуро, пипетки, предметные и покровные стекла, мерные цилиндры и стаканы, конические колбы на 100 см3 и 50 см3, лабораторная пипетка, ватно-марлевые пробки, дистиллированная вода, спирт.
| Виды стерилизации | Методы стерилизации | Действующий агент |
| Физический | паровой (автоклавирование) | пар под избыточным давлением (120 0С, давление 1,1 атм) (132 0С, давление 2,0 атм) |
| воздушный | сухой воздух при 180 °С | |
| гласперленовый | нагретые стеклянные шарики при 190-240 0С | |
| инфракрасный | инфракрасное излучение при 200±3 0С | |
| лучевой | ионизирующее излучение 2- 2,5 Мрад | |
| ультразвуковой | механические колебания с частотой от 2х104 до 2х10 8 в сек | |
| Химический | жидкостной | растворы химических соединений (альдегид-, кислород-, хлорсодержащих) |
| газовый | окись этилена в смеси с углекислым газом, бромистым метилом и др. | |
| плазменный | пары 20 % пероксида водорода | |
| Радиоционный | гамма-илучение | стерилизация в промышленных установках |
Паровой метод стерилизации (автоклавирование)
Впервые стерилизация паром под повышенным давлением в автоклаве осуществлена в 1884 году Л.Л. Гендейрейхом.
При этом способе стерилизации действующим агентом является горячий пар. В автоклаве возможно нагревание воды под повышенным давлением, что приводит к по-вышению точки кипения воды и соответственно пара до 132 0С (при давлении 2 атм.).
Паровым методом стерилизуют общие хирургические и специальные инструменты, детали приборов и аппаратов из коррозионно-стойких металлов, стекла, шприцы с пометкой 200 0С, хирургическое белье, перевязочный и шовный материал, изделия из резин (перчатки, трубки, катетеры, зонды и т.д.), латекса, отдельных видов пластмасс.
Воздушный метод стерилизации
При воздушном методе стерилизации стерилизующим средством является сухой горячий воздух температурой 1600С и 1800С; стерилизацию осуществляют в суховоздушных стерилизаторах.
Воздушным методом стерилизуют хирургические, гинекологические, стоматологические инструменты, детали приборов и аппаратов, в том числе изготовленные из коррозионно-нестойких металлов, шприцы с пометкой 200 0С, инъекционные иглы, изделия из силиконовой резины.
Стерилизация в среде нагретых стеклянных шариков (гласперленовая)
В стерилизаторах, стерилизующим средством в которых является среда нагретых стеклянных шариков (гласперленовые шариковые стерилизаторы), стерилизуют изделия, применяемые в стоматологии (боры зубные, головки алмазные, дрильборы, а также рабочие части гладилок, экскаваторов, зондов и др.). При стерилизации стеклянные шарики нагреваются до температуры 190-240 0С. Стерилизация проводится в течение 5 - 15 секунд.
Инфракрасная стерилизация
Существуют стерилизаторы, в которых используется метод, основанный на применении кратковременного импульсного инфракрасного излучения, создающего в рабочей камере температуру 200±30С. Время инфракрасной стерилизации инструментария в неупакованном виде составляет от 10 до 25 минут. Недостатками данного метода стерилизации являются отсутствие упаковки инструментов, повреждающее воздействие на полимерные материалы и резину, отсутствие контролирующих индикаторов.
Лучевая стерилизация
Используют гамма и бета - частицы и относительно тяжелые нейтроны, протоны и т. д. Метод применяется для стерилизации одноразовых инструментов (шприцы, шовный материал, катетеры, зонды, системы для переливания крови, перчатки и др.). При сохранении целостности упаковки стерильные свойства предметов сохраняются в течение 5 лет.
Ультразвуковая стерилизация
Ультразвуковые волны используются для стерилизации инструментов, подготовки рук медицинского персонала к операции. Для этого руки (инструменты) погружают в специальную ванну с дезинфицирующим раствором, через который пропускают ультразвуковые волны.
Стерилизация растворами химических средств
Данный метод следует применять для стерилизации изделий, в конструкцию которых входят термолабильные материалы, то есть в тех случаях, когда особенности материалов изделий не позволяют использовать другие официально рекомендуемые методы стерилизации.
При стерилизации растворами химических средств используют стерильные емкости из стекла, металлов, термостойких пластмасс, выдерживающих стерилизацию паровым методом, или покрытые эмалью (эмаль без повреждений).
Газовая стерилизация
Для газового метода стерилизации используют смесь ОБ (смесь окиси этилена и бромистого метила в весовом соотношении 1:2,5 соответственно), окись этилена, пары раствора формальдегида в этиловом спирте, а также озон.
Стерилизацию смесью ОБ и окисью этилена проводят при комнатной температуре (не менее 180С), при температуре 350С и 550С, парами раствора формальдегида в этиловом спирте при температуре 800С.
Вывод: в результате проделанной работы нами были изучены такие виды стерилизации как: химический, физический, радиационный, так же они подразделяются на множество методов.
Лабораторная работа №3.
Механическое разрушение клеток.
Цель: ознакомиться и сравнить методы эффективности разрушения клеток.
Материалы и оборудование: дрожжевая суспензия, предметные стекла, стеклянная палочка с шероховатой поверхностью, водяная баня, кварцевый песок, микроскоп, дистиллированная вода, мерные стаканы и цилиндры, фарфоровая ступка с пестиков, краситель, лабораторная плитка.
Методы разрушения клеток.
Разрушение клеток проводится физическими, химическими и ферментативными методами. Наибольшее промышленное значение имеют физические способы дезинтеграции:
- ультразвуком;
- лопаточными или вибрационными дезинтеграторами – метод, обычно используемый в пилотных и промышленных установках;
- встряхиванием со стеклянными бусами;
- продавливанием через узкие отверстия под высоким давлением;
- раздавливанием замороженной массы;
- растиранием в специальных ступках;
- с помощью осмотического шока;
- многократным замораживанием и оттаиванием;
- сжатием клеточной взвеси с последующим резким снижением давления (декомпрессией).
Физические способы дезинтеграции отличаются большей экономичностью в сравнении с другими методами, однако они характеризуются отсутствием выраженной специфичности, вследствие чего обработка может отрицательно влиять на качество получаемого целевого продукта.
Мягкое и избирательное разрушение клеточной стенки обеспечивается применением химических и ферментативных методов. Так, бактериальные клетки разрушаются лизоцимом в присутствии ЭДТА (этилендиаминтетрауксусной кислоты), а клеточные стенки дрожжей зимолиазой улитки или ферментами грибного либо актиномицетного происхождения. Клеточные стенки микроорганизмов могут быть разрушены путем обработки толуолом или бутанолом. Элективный лизис клеток вызывается воздействием ряда антибиотиков: полимиксин, новобиоцин, нистатин и др. Кроме того, к аналогичным результатам приводит обработка клеток некоторыми поверхностно-активными веществами.
Вывод: в результате проделанной работы ознакомились и сравнили методы разрушения клеток.
Лабораторная работа №4.
Фазы роста микробиологических культур и расчет кинетических параметров.
Цель: ознакомиться с циклом развития микробных культур и спецификой периодической культуры. Построить кривые.
Материалы и оборудование: культура дрожжей, стерильный раствор базового фосфатного буфера для среды, маточные стерильные растворы микроэлементов, цитрат натрия, сульфат магния, шпатели, спиртовка, мерная посуда, пипетки, колбы для выращивания бактерий, ватно-марлевые пробки, качалка.
Ход работы:
До добавления дрожжей оптическая плотность 0,120
Периодические измерения проб культуры на спектрофотометре при длине волны λ – 530нм
Табл.1. Измерение оптической плотности культуры на спектрофотометре.
| № время | 10.10 | 11.10 | 12.10 | 13.10 | 14.10 | 15.10 | 16.10 | След.день. 15.10 |
| Колба 1 | 2,292 | 2,281 | 2,370 | 2,358 | 2,366 | 2,393 | 2,383 | 2,168 |
| Колба 2 | 2,313 | 2,266 | 2,268 | 2,345 | 2,371 | 2,402 | 2,397 | 2,144 |
По данным таблицы строим кривые роста культур.
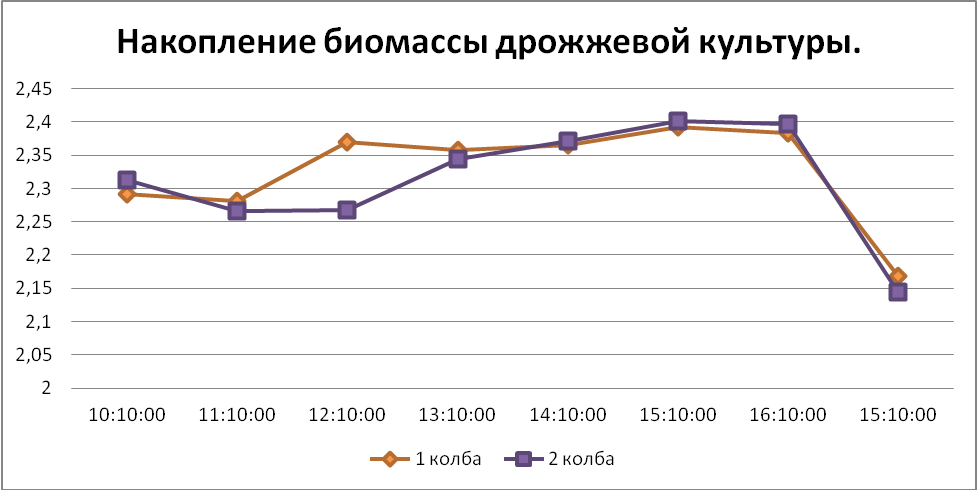
Вывод: в результате проделанной работы мы ознакомились с циклом развития микробных культур и спецификой периодической культуры, так же нами была построена кривая, из которой видно, что фаза экспонтециального роста стремительно росла на протяжении 1 часа, затем идет стационарная фаза медленного накопления биомассы, затем идет резкая фаза отмирания. Мы предполагаем, что задержка в фазе роста может быть вызвана старой культурой дрожжей.
Лабораторная работа №5.
Периодическое культивирование и культивирование с подпиткой субстратом.
Цель: обучение технике культивирования микроорганизмов в режиме периодического процесса
Материалы и оборудование: культура дрожжей, стерильный раствор базового фосфатного буфера для среды, маточные стерильные растворы микроэлементов, цитрат натрия, сульфат магния, шпатели, спиртовка, мерная посуда, пипетки, колбы для выращивания бактерий, ватно-марлевые пробки, качалка.
Ход работы.
До добавления дрожжей оптическая плотность 0,120
Периодические измерения проб культуры на спектрофотометре при длине волны λ – 530нм
Табл.2. Измерение оптической плотности культуры на спектрофотометре. Добавление глюкозы.
| № время | 10.10 | 11.10 | 12.10 | 13.10 | 14.10 | 15.10 | 16.10 | След.день 15.10 |
| Колба 1 | 2,288 | 2,195 | 2,281 | 2,274 | 2,268 | 2,311 | 2,285 | 1,563 |
| Колба 2 | 2,228 | 2,162 | 2,278 | 2,179 | 2,214 | 2,275 | 2,307 | 2,022 |
| Колба 3 | 2,276 | 2,193 | 2,314 | 2,208 | 2,303 | 2,339 | 2,325 | 2,374 |
| Колба 4 | 2,276 | 2,281 | 2,258 | 2,171 | 2,314 | 2,326 | 2,354 | 2,366 |
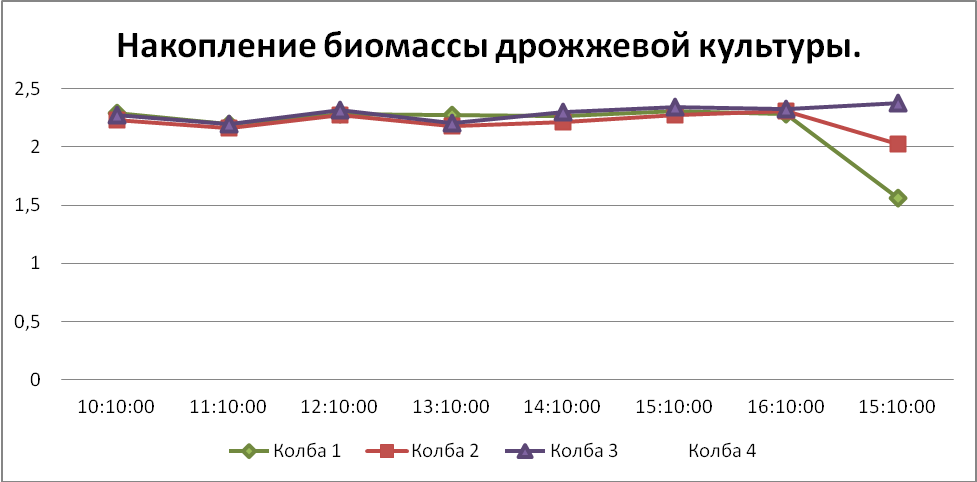
Вывод: в результате проделанной работы мы обучили технику культивирования микроорганизмов в режиме периодического процесса, построили кривую, на которой видно, что фаза экспоненциального роста стремительно росла на протяжении 1 часа после добавления раствора глюкозы на 2 и 4 часу, затем шла стационарная фаза медленного накопления биомассы без сильной реакции на добавления подкормки на 6 и 8 часах, и, далее шла резкая фаза отмирания. Некоторая задержка в вазе роста может быть вызвана старой культурой дрожжей. У 4 колбы показания резко отличаются в начале от общей картины, вероятно на стенках колбы было какое-то вещество угнетающее рост культуры.