Занятия 14
Подкисление дождевых вод в атмосфере городских территорий
Загрязнение атмосферного воздуха является проблемой больших промышленно развитых городов. Кроме традиционных проблем связанных с дымлением стационарных источников загрязнения атмосферы, возникают проблемы обусловленные эксплуатацией автомобилей, число которых на улицах городов из года в год растет.
Основным процессом трансформации, происходящим в атмосфере, является окисление, что закономерно для атмосферы, в состав которой в качестве основного компонента входит кислород.
Подкисление дождевых вод
На величину рН водной среды влияет механизм гидратации газов в воде. Наиболее известной реакцией является растворение диоксида углерода (СО2), который придает природной дождевой воде характерное для нее значение рН:
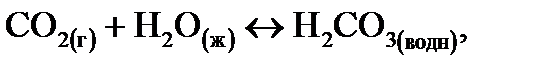 (14.1)
(14.1)
 (14.2)
(14.2)
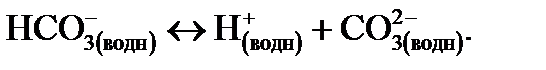 (14.3)
(14.3)
Уравнение (14.3) не является важным для атмосферы, таким образом, значение рН капельки воды в равновесии с атмосферным СО2 может быть определено путем комбинирования двух первых уравнений для равновесных констант, которые определяются законом растворения Генри и диссоциацией. Если угольная кислота (Н2СО3) – это единственный источник протонов, то с Н+ должно быть обязательно равно 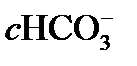 . Условие равновесия для уравнения (14.2) может быть записано так:
. Условие равновесия для уравнения (14.2) может быть записано так:
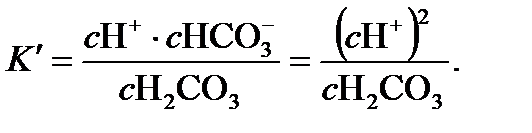 (14.4)
(14.4)
Константа Генри, определяемая с помощью уравнения (14.1), равна:
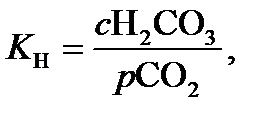 (14.5)
(14.5)
откуда с Н2СО3 соответствует K Н ∙ р СО2, что можно подставить в уравнение (14.4).
Преобразовав, получим
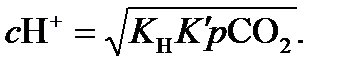 (14.6)
(14.6)
Подставляя нужные значения равновесных констант (табл. 14.1) и взяв парциальное давление СО2 (р СO2) равным 336 ∙ 10–4 %, т. е. 3,6 ∙ 10–4 атм, получим концентрацию водородных ионов (Н+), равную 2,4 ∙ 10–6 моль/л, или рН 5,6.
Таблица 14.1
Константы Генри и первые константы диссоциации для атмосферных газов, претерпевающих гидролиз
| Газ | K H, моль/(л ∙ атм) | K', моль/л |
| Диоксид серы | 2,0 | 2,0 ∙ 10–2 |
| Диоксид углерода | 0,04 | 4,0 ∙ 10–7 |
Диоксид серы (SO2) находится в атмосфере в гораздо меньших концентрациях, но он имеет большие растворимость и константу диссоциации. Приведем уравнения, аналогичные таковым для СО2:
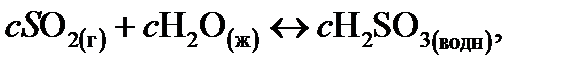 (14.7)
(14.7)
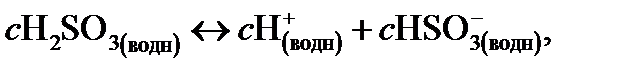 (14.8)
(14.8)
и, вновь преобразовав, получим
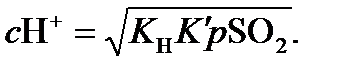 (14.9)
(14.9)
Если небольшое количество SО2 присутствует ввоздухе в концентрации 5 ∙ 10–9 атм (что вполне вероятно для воздуха над континентами), можно получить значение рН 4,85. Таким образом, даже низкие концентрации SO2 имеют огромное влияние для капельки воды.
Окисление неметаллов приводит к накоплению кислых соединений, и именно это объясняет ту легкость, с которой происходит окисление в атмосфере. Соединения углерода могут быть окислены до органических соединений, таких, как муравьиная кислота (НСООН) или уксусная кислота (СН3СООН), или, более полно, до угольной кислоты (Н2СО3, т. е. растворенной углекислоты). Из соединений серы может образовываться Н2SО4 или, в случае некоторых органических соединений серы, метансульфоновая кислота (СН3SО3Н). Соединения азота могут быть, в конце концов, окислены до НNО3. Растворимость многих из этих соединений в воде делает дождь эффективным механизмом удаления их из атмосферы. Этот процесс известен как «вымывание».
Важно отметить, что даже в отсутствие SО2 атмосферные капельки будут иметь кислую реакцию из-за растворения СO2. Рассмотрим вклад SО2 в кислотность атмосферных капелек воды на примере последовательности реакций, которые могут вызвать гораздо более сильное подкисление:
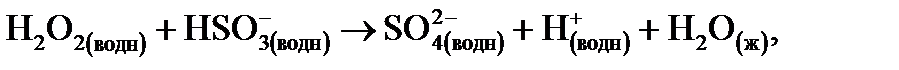 (14.10)
(14.10)
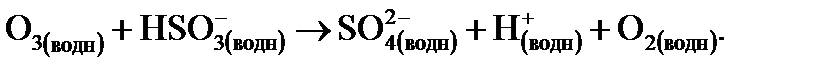 (14.11)
(14.11)
Перекись водорода (Н2О2) и О3 являются природными сильными окислителями, присутствующими в дождевой воде. Потенциально эти окислители могут окислить почти весь SО2 в некотором объеме воздуха. В таких условиях дождевая вода вполне может иметь значения рН ниже 3. Это иллюстрирует возможные высокие концентрации кислоты в атмосфере в результате того, что следовые загрязнители переходят из газовой фазы в капельки. Жидкая вода в атмосфере имеет объем примерно в миллион раз меньший, чем газовая фаза; таким образом, в результате растворения происходит существенное увеличение концентрации.
После того как вода падает на землю, может иметь место дальнейшее повышение концентрации, если вода замерзнет в виде снега. В процессе таяния снега происходит преимущественная потеря растворенных ионов, поскольку они стремятся накапливаться снаружи зерен льда. Это означает, что на ранних стадиях таяния выносится именно растворенная Н2SО4. Возможна ее 20-кратная концентрация. Весной, когда тает первый снег, это имеет серьезные последствия для водных организмов и, особенно для их потомства.
Для газообразных загрязнителей или частиц возможен и прямой вынос из атмосферы на поверхность земли в процессе, известном как сухое осаждение. Он может иметь место на земле или на море, но все равно называется «сухим осаждением». На самом деле это не совсем правильное употребление термина, поскольку поверхности, доступные для сухого осаждения, наиболее эффективны, когда они увлажнены.
Пример
Рассмотрим на примере подкисление дождевых вод диоксидом серы. Считается, что над сельской местностью или индустриальным районом диоксида серы SО2 содержится в концентрации 5,0 ∙ 10–9 атм.
Целью расчета является оценка рН дождевых вод.
По условию кубический метр воздуха содержит 5,0 ∙ 10–9 м3 SО2. Поскольку моль газа занимает 0,0245 м3 при 15 ºС и атмосферном давлении, это значение легко перевести в моли. Таким образом, 1 м3 воздуха содержит
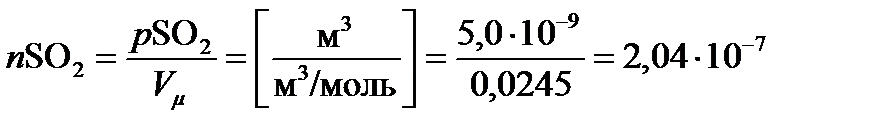 , моль SO2.
, моль SO2.
Допустим, что дождевое облако объемом 1 м3 содержит около 1 гжидкой воды, или0,001 дм3. Если весь SО2 перейдет в жидкую фазу (капельку воды) и окислится до серной кислоты (Н2SО4), то концентрация в жидкой фазе составит
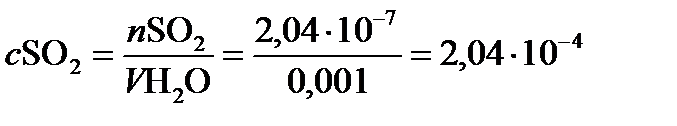 , моль/л.
, моль/л.
Образующаяся Н2SО4 является сильной кислотой и диссоциирует в атмосферных условиях с образованием двух протонов:
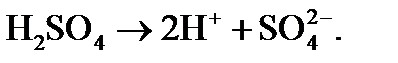
Таким образом, концентрация протонов водорода будет 4,08 ∙ 10–4 моль/л, или 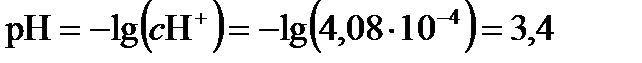 . Испарение воды из капельки и дальнейший перенос SО2 в каплю при падении капельки через воздух ниже облака могут привести дальнейшему понижению рН.
. Испарение воды из капельки и дальнейший перенос SО2 в каплю при падении капельки через воздух ниже облака могут привести дальнейшему понижению рН.