Задание 1. А Приведите характе-ристику элемента на основании его поло-жения в периоди-ческой системе Д. И. Менделеева
Sb, Mn
51Sb - – 5 период, 5 группа, главная подгруппа, относится к p-семейству
Электронная формула:
1s22s22p63s23p43d104s24p64d105s25p3
Электронно-графическая формула:
| ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ |
1s2 2s2 2p 6 3s2 3p6 3d10
| ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ |
4s2 4p6 d10
| ↓↑ | ↑ | ↑ | ↑ |
5s2 5p3
В основном состоянии В=3
51Sb*
| ↑ | ↑ | ↑ | ↑ | ↑ |
5s1 5p3 5 d1
В возбужденном состоянии В=5
Степени окисления:
0 – Sb
-3 – H3Sb
+3 – Sb2O3
+5 - Sb2O5, HSbO3, NaSbO3
25Mn – 4 период, 7 группа, побочная подгруппа, относится к d-семейству
Электронная формула:
1s22s22p63s23p63d54s2
Электронно-графическая формула:
| ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↑ | ↑ | ↑ | ↑ | ↑ |
1s2 2s2 2p 6 3s2 3p6 3d5
| ↑↓ |
4s2
В основном состоянии В=5
Mn*
Электронная формула:
1s22s22p63s23p63d54s14p1
Электронно-графическая формула:
| ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↑ | ↑ | ↑ | ↑ | ↑ |
1s2 2s2 2p 6 3s2 3p6 3d5
| ↑ | ↑ |
4s1 4p 1
В возбужденном состоянии В=7
Степени окисления:
0 – Mn
+2 – MnO, Mn(OH)2
+3 – Mn2O3
+4 – MnO2
+7 – Mn2O7, HMnO4
Задание 1. Б Укажите тип связи в данных молекулах
H2Se, ∆ЭО= 2,55-2,1=0,4 5<2 – связь ковалентная полярная
MgO ∆ЭО= 3,5-1,2=2,3 >2 – связь ионная
Задание 1. в) По методу валентных связей постройте графические формулы молекул
C H3 CОН,
С 2s22p2
| ↓↑ | ↑ | ↑ |
С* 2s12p3
| ↑ | ↑ | ↑ | ↑ |
В=4
O 2s22p4
| ↓↑ | ↓↑ | ↑ | ↑ |
В=2
H 1s1
| ↑ |
В=1

Атом углерода 1 в состоянии sp2-гибридизации, Атом углерода 2 в состоянии sp3-гибридизации
SbCl 3
Sb 5s25p3 В=3
| ↓↑ | ↑ | ↑ | ↑ |
5s2 5p3
Сl 3s23p5 В=1
| ↓↑ | ↓↑ | ↓↑ | ↑ |
3 неспаренных электрона сурьмы объединяются с тремя неспаренными электронами атомов хлора и образуют 3 ковалентные связи

Атом Sb – sp3-гибридизация
Форма молекулы – тригональная пирамида
Задание 2
| Номер вариан-та | Составьте формулы оксидов, гидрокси-дов, солей, докажите характер гидрокси-дов уравнениями реакций в молеку-лярном и ионном виде | Исходя из дан-ных соединений составьте форму-лы средних, кис-лых и основных солей. Назовите их.Составьте гра-фические форму-лы. | .В молекулярном и ионном виде напишите уравнения реакций с по-мощью которых можно осуществить превращения. |
| Cr+3; Pb+2; C+4 | H3PO4; Ca(OH)2 | Zn→ZnO→Na2ZnO2→Zn(OH)2→ →ZnSO4 |
Cr+3; Сr2O3, Cr(OH)3, CrCl3
Cr(OH)3 – амфотерный гидроксид
Cr(OH)3 + 3HCl= CrCl3 + 3H2O
Cr(OH)3 + 3H+ + 3Cl-= Cr3+ + 3Cl- + 3H2O
Cr(OH)3 + 3H+ = Cr3+ + 3H2O
Cr(OH)3 + 3NaOH= Na3[Cr(OH)6]
Cr(OH)3 + 3Na+ + 3OH-= 3Na+ + [Cr(OH)6]3-
Cr(OH)3 + 3OH-= [Cr(OH)6]3-
Pb+2 PbO, Pb(OH)2, PbCl2
Pb(OH)2 амфотерный гидроксид
Pb(OH)2 + 2HCl= PbCl2 + 2H2O
Pb(OH)2 + 2H+ + 2Cl-= Pb2+ + 2Cl- + 2H2O
Pb(OH)2 + 2H+ = Pb2+ + 2H2O
Pb(OH)2 + 2NaOH= Na2[Pb(OH)4]
Pb(OH)2 + 2Na+ + 2OH-= 2Na+ + [Pb(OH)4]2-
Pb(OH)2 + 2OH-= [Pb(OH)4]2-
C+4 CO2, H2CO3, Na2CO3
H2CO3 кислота
H2CO3 + 2NaOH = Na2CO3 + 2H2O
H2CO3 + 2NaOH = Na2CO3 + 2H2O
H3PO4
NaH2PO4 дигидрофосфат натрия

Na2HPO4 гидрофосфат натрия

Na3PO4 фосфат натрия

Ca(OH)2
СaCl2 хлорид кальция
Сl-Ca-Cl
CaOHCl гидроксохлорид кальция
Сl-Ca-OH
Zn→ZnO→Na2ZnO2→Zn(OH)2→ →ZnSO4
1) 2Zn+ O2 =2ZnO
2) ZnO + 2NaOH = Na2ZnO2+ H2O
ZnO + 2Na+ +2OH- = 2Na+ + ZnO22-+ H2O
ZnO +2OH- = ZnO22-+ H2O
3) Na2ZnO2 + 2HCl = Zn(OH)2 + 2NaCl
2Na+ + ZnO22-+ 2H+ +2Cl- = Zn(OH)2 + 2Na+ + 2Cl-
ZnO22-+ 2H+= Zn(OH)2
4) Zn(OH)2+ H2SO4 = ZnSO4 + 2H2O
Zn(OH)2+ 2H+ + SO4 2- = Zn2+ + SO4 2- + 2H2O
Zn(OH)2+ 2H+ = Zn2+ + 2H2O
Задание 3. Реакция образования оксида азота (ΙV) выражается уравнением 2NO+O2=2 NO2.
Как изменится скорость прямой и обратной реакций, если давление уве-личить в 2 раза, а температуру оставить постоянной? Вызовет ли это из-менение скоростей смещение равновесия? (Ответ: скорость прямой реак-ции увеличилась в 8 раз, скорость обратной реакции увеличилась в 4 раза).
Решение
Запишем кинетическое уравнение прямой реакции:
v=k∙[NO]2∙[O2] по закону действующих масс
Пусть x – концентрация NO, y – концентрация O2. Тогда скорость реакции равна:
v=kx2y
Давление прямо пропорционально концентрации газа.
Тогда при увеличении давления в 2 раза концентрации обоих веществ увеличатся в 2 раза. Концентрация NO станет равной 2х моль/л, концентрация O2 станет равной 2у моль/л.
Скорость реакции после увеличения давления станет равной:
v’=k(2x)2∙2y=8 kx2y
Отношение скоростей равно: v’/v=8 kx2y/ kx2y=8
Запишем кинетическое уравнение обратной реакции:
v=k∙[NO2]2 по закону действующих масс
Пусть x – концентрация NO2. Тогда скорость реакции равна:
v=kx2
Давление прямо пропорционально концентрации газа.
Тогда при увеличении давления в 2 раза концентрация NO2 станет равной 2х моль/л.
Скорость реакции после увеличения давления станет равной:
v’=k(2x)2=4 kx2
Отношение скоростей равно: v’/v=4 kx2/ kx2=4
Равновесие сместится в сторону продуктов реакции. Согласно вычислениям
ЗАДАНИЕ 3
| № | Составьте уравнения диссоциации следующих соединений | Напишите молекулярные и ионные уравнения реакций | |
| Обмена | Гидролиза солей | ||
| H2SO4, Zn(OH)2 | AlCl3 + 2NaOH → AgNO3 + KCl → | NaHS, Zn(NO3)2, Fe2 (CO3)2 |
H2SO4= H+ + HSO4-
HSO4-=H+ + SO42-
Zn(OH)2 =ZnOH+ + OH-
ZnOH+ = Zn2+ + OH-
AlCl3 + 3NaOH =Al(OH)3 + 3NaCl
Al3+ + 3Cl- + 3Na+ + 3OH- =Al(OH)3 + 3Na+ + 3Cl-
Al3+ + 3OH- =Al(OH)3
AgNO3 + KCl = AgCl + KNO3
Ag+ + NO3 - + K+ + Cl- = AgCl + K+ + NO3-
Ag+ + Cl- = AgCl
NaHS – cоль сильного основания и слабой кислоты, гидролизуется по аниону
NaHS + H2O = H2S + NaOH
Na+ + HS- + H2O = H2S + Na+ + OH-
- + H2O = H2S + OH-
Zn(NO3)2 – cоль слабого основания и сильной кислоты, гидролизуется по катиону
Zn(NO3)2 + H2O = ZnOH + HNO3
Zn2+ + 2NO3- + H2O = ZnOH+ + NO3 - + H+ + NO3-
Zn2+ + H2O = ZnOH+ + H+
Fe2 (CO3)3 cоль слабого основания и слабой кислоты, гидролизуется по катиону и аниону
Fe2 (CO3)3 + 3H2O = 2Fe(OH)3 + 3CO2
| № варианта | Закончите окислительно - восстановительные реакции |
| KClO3 + NaNO2 +H2SO4→Cl2 + NaNO3 +K2SO4 +H2O CO+KMnO4+H2SO4→CO2+MnSO4+K2SO4+H2O J2+NaOH→NaJ+NaJO3+H2O |
2KClO3 + 5NaNO2 +H2SO4→Cl2 + 5NaNO3 +K2SO4 +H2O
2Cl+5 + 10e = Cl20 │5 восстановитель
N+3 – 2e = N+5│5 восстановитель
5CO+2KMnO4+3H2SO4→5CO2+2MnSO4+K2SO4+3H2O
С+2 – 2e = C+4│5 восстановитель
Mn+7 + 5e = Mn+2│2 окислитель
3J2+6NaOH→5NaJ+NaJO3+3H2O
J2+ 2e = 2J- │5 окислитель
J2 - 10e = 2JO3- │1 восстановитель
Задание 5
1.Опишите химическими реакциями механизм коррозии на воздухе.
2. Составьте уравнения реакций
3. С какими из перечисленных веществ будут взаимодействовать указанные металлы? Напишите соответствующее уравнение реакций металла с растворами H2SO4конц, H2SO4разб, NaOH, H2O, HNO3разб, HNO3конц.
4. A) Опишите работу гальванического элемента, в котором данный металл является: а) анодом, б) катодом; укажите реакции, происходящие на аноде и катоде; рассчитайте ЭДС (по стандартным электродным потенциалам). Б) Какие реакции происходят на аноде и катоде при электролизе водного раствора, в котором содержатся три соли?
Задание 5
Таблица 3
| Номерварианта | Задание 1 | Задание 2 | Задание 3 | Задание 4 | |
| А | Б | ||||
| Al/Cu | Mg + NH4Cl + H2O→ Hg + HNO3 → | Fe, Be | Ni | Fe(NO3)3, NaNO3 |
1. Al aктивнее Cu. Al будет анодом, Сu катодом
На аноде идет процесс: Al -3 e = Al3+
На катоде идет процесс O2 + 2H2O + 4e = 4OH-
Al + 3O2 + 6H2O = 4Al(OH)3
2. Mg + NH4Cl + H2O= MgCl2 + H2 + NH4OH
Hg + 4HNO3 = Hg(NO3)2 + 2NO2 + 2H2O
3. Fe, Be с водой не взаимодействуют
Be + H2SO4 (разб)= BeSO4 + H2
3Be + 4H2SO4 (конц)= 3BeSO4+ S + 4H2O
Be + 2NaOH = Na2BeO2 +H
3Be + 8HNO3 разб = 3Be(NO3)2 + 2NO + 4H2O
Be не реагирует с HNO3конц.
Fe+ H2SO4 (разб)= FeSO4 + H2
Fe+ 4HNO3 разб = Fe(NO3)3 + NO + 2H2O
Fe не реагирует с HNO3конц., H2SO4конц, NaOH
4.:
A (-) Ni│NiSO4 ││CuSO4 │Cu K (+)
На электродах происходят процессы:
(–) А: Ni – 2e- = Ni2+; окисление
(+) K: Cu2+ + 2e- = Cu. восстановление
ЭДС== Eк - Eа=+0,34-(-0,25)=0,59 В
A (-) Zn│ZnSO4 ││NiSO4 │Ni K (+)
На электродах происходят процессы:
(–) А: Zn – 2e- = Zn2+; окисление
(+) K: Ni2+ + 2e- = Ni. восстановление
ЭДС== Eк - Eа=-0,25-(-0,76)=0,51 В
4 Б
Fe(NO3)3, NaNO3
На катоде идут процессы при электролизе:
Fe3+ + 3e = Fe0
2H2O + 2e = H2 + 2OH-
На аноде идет процесс 2H2O – 4 e = O2 + 4H+
| Номер варианта | Осуществите превращения, найдите продукты реакции |
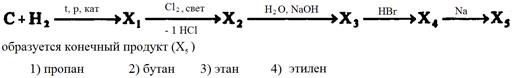
|
1) C + 2H2 = CH4 метан
2) CH4 + Сl2 = CH3Cl + HCl
3) CH3Cl + NaOH = CH3OH +NaCl
4) CH3OH + HBr = CH3Br + H2O
5) 2CH3Br + 2Na = CH3-CH3 + 2NaBr
этан