Дисциплина: Химия
Раздел 2. Общие закономерности химических процессов
УЧЕБНОЕ ЗАДАНИЕ № 5 «ОПРЕДЕЛЕНИЕ ЭНТАЛЬПИИ ХИМИЧЕСКОЙ РЕАКЦИИ НА ОСНОВАНИИ ДАННЫХ ОПЫТА»
Лабораторная работа № 4 «Определение энтальпии гидратации безводного cульфата меди»
Этап индивидуальной работы
1. Разместите структурированную информацию (результат работы с информационными источниками) в ниже приведенную Табл. 1.
Таблица 1. Результаты работы с информационными источниками
| тема | «Определение энтальпии реакции присоединения кристаллизационной воды к безводной соли (энтальпия гидратации)» |
| форма организации информации | Энтальпию реакции присоединения кристаллизационной воды к безводной соли можно определить, зная изменение энтальпии при растворении безводной солии изменение энтальпии при растворении кристаллогидрата этой соли. В термохимии под энтальпией растворения понимают изменение энтальпии процесса растворения 1 моля вещества в большом количестве растворителя, т.е. в таком его количестве, когда дальнейшее разбавление раствора не влияет на величину энтальпии растворения (это так называемая дифференциальная энтальпия растворения). Энтальпия растворения веществ состоит в основном из двух слагаемых: энтальпии процесса перехода твердого или газообразного вещества в то состояние, в котором оно существует в растворе ∆Hр, и энтальпии процесса взаимодействия вещества с растворителем (энтальпия сольватации) ∆Hс. В зависимости от величины и знака этих двух слагаемых процесс растворения может быть эндотермическим или экзотермическим. Для газов ∆Hр < 0 и величина ∆Hр представляет собой энтальпию конденсации при изменении объема газа до объема жидкого раствора. У твердых веществ ∆Hр > 0, т.к. при их растворении затрачивается энергия на разрушение кристаллической решетки. Таким образом, процесс растворения соли может быть представлен в виде двух этапов: разрушение кристаллической решетки соли с образованием раствора ее и взаимодействия частиц соли с растворителем. Процесс же растворения кристаллогидрата соли состоит только из разрушения кристаллической решетки, т.к. взаимодействия частиц кристаллогидрата с растворителем, можно считать, не происходит (молекулы соли уже связаны с молекулами растворителя). Следовательно, энтальпия растворения безводной соли и ее кристаллогидрата отличается на величину энтальпии гидратации ∆Hгидр. |
2. Заполните таблицу 2, для этого рассмотрите схемы процесса растворения безводного сульфата меди (II), запишите термохимические уравнения и обозначения энтальпий для каждой стадии процесса:
Таблица 2. Стадии процесса растворения безводного сульфата меди (II)
| Схема и энтальпии процесса растворения | |||||||
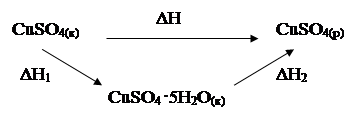 | ΔH = ΔH1 + ΔH2 ΔН2 = – 11,48 кДж | ||||||
| Стадии процесса растворения CuSO4 | |||||||
| гидратация безводного сульфата меди (II) | CuSO4(к) + 5H2O(ж) = CuSO4 · 5H2O(к), ΔН1 | ||||||
| растворение кристаллогидрата меди (II) | CuSO4 ·5H2O(к) = CuSO4(р) + 5H2O(ж), ΔН2 | ||||||
3. Напишите отчет по лабораторной работе.Впишите в табл. 3 результаты наблюдений, формулы соединений, значения параметров и справочные данные, расчеты по формулам, выводы:
Таблица 3
Результаты индивидуальных наблюдений и предварительные соображения
| Результаты наблюдений | ||
| вещество | формула с обозначением агрегатного состояния | цвет |
| безводный сульфат меди (II) | CuSO4(к) | белый |
| растворенный сульфат меди (II) | CuSO4 (р) | голубой |
| Расчеты | ||
| Значения параметров и справочные данные | ||
| Масса безводной соли (m1), г | ||
| масса воды (m2), г | ||
| масса раствора (m), г | 100+5=105 | |
| начальная температура (t1), 0C | 25оС | |
| конечная температура (t2), 0C | 27оС | |
| удельная теплоемкость раствора (c), Дж/(г·К) | 4,18 | |
| молярная масса CuSO4 (M), г/моль | ||
| Расчеты по формулам | ||
| Количество теплоты, выделившейся при растворении соли, кДж | 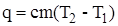 = = 
| |
| Количество теплоты, выделяющейся при растворении 1 моль CuSO4, кДж/ моль |  
| |
| Энтальпия растворения безводного сульфата меди (II), кДж/ моль | ΔН = – Q = – 26,8 кДж/моль | |
| Энтальпия гидратации безводного сульфата меди (II), кДж/ моль | ΔH1 = ΔH - ΔН2 ΔH1= –26,8 – 11,48 = – 38,28 | |
| Выводы | ||
| Гидратация безводного сульфата меди является экзотермическим процессом. | ||
| Термохимическое уравнение гидратации безводного сульфата меди (II): CuSO4(к) + 5H2O(ж) = CuSO4 · 5H2O(к), ΔН1= – 38,28 кДж/моль |
Количество теплоты, выделившейся при растворении соли, кДж
q=cm(T2−T1)=  836 ⋅10–3кДж= 0,836кДж
836 ⋅10–3кДж= 0,836кДж
4. Прикрепить свою работу в разделе «Загрузка файла» для проверки.