Как теперь известно ученым, вирусы окружают нас повсюду в живой природе. И каждая клетка каждого живого организма несет в себе следы прошлых встреч с ними. Генетическое разнообразие вирусов, их умение меняться и приспосабливаться, а также их огромное количество в природе — поражают. Предполагается, что общее число вирусных частиц на порядок выше количества всех клеток всех организмов на Земле [1]. Миллионы лет назад ретроэлементы и ретровирусы участвовали в эволюции, выступая в качестве генетического резервуара для создания новых генов и усложнения видов. Этот вопрос подробно исследовали и нашли массу подтверждающих фактов российские генетики из Института биоорганической химии РАН (академик Е.Д. Свердлов, А.А. Буздин и их коллеги) [2, 3]. И сейчас вирусы могут выступать одним из «орудий» эволюции, регулируя численность и жизнеспособность популяций*.
В 2007 году сотрудники биологического факультета МГУ Л. Нефедова и А. Ким описали, как мог появиться один из видов вирусов — ретровирусы. Они провели сравнительный анализ геномов дрозофилы D. melanogaster и ее эндосимбионта (микроорганизма, живущего внутри дрозофилы) — бактерии Wolbachia pipientis. Полученные данные показали, что эндогенные ретровирусы группы gypsy могли произойти от мобильных элементов генома — ретротранспозонов. Причиной этому стало появление у ретротранспозонов одного нового гена — env, — который и превратил их в вирусы. Этот ген позволяет вирусам передаваться горизонтально, от клетки к клетке и от носителя к носителю, чего ретротранспозоны делать не могли. Именно так, как показал анализ, ретровирус gypsy передался из генома дрозофилы ее симбионту — вольбахии [7]. Это открытие упомянуто здесь не случайно. Оно нам понадобится для того, чтобы понять, чем вызваны трудности борьбы с вирусами.
Из давних письменных источников, оставленных историком Фукидидом и знахарем Галеном, нам известно о первых вирусных эпидемиях, возникших в Древней Греции в 430 году до н.э. и в Риме в 166 году. Часть вирусологов предполагает, что в Риме могла произойти первая зафиксированная в источниках эпидемия оспы. Тогда от неизвестного смертоносного вируса по всей Римской империи погибло несколько миллионов человек [8]. И с того времени европейский континент уже регулярно подвергался опустошающим нашествиям всевозможных эпидемий — в первую очередь, чумы, холеры и натуральной оспы. Эпидемии внезапно приходили одна за другой вместе с перемещавшимися на дальние расстояния людьми и опустошали целые города. И так же внезапно прекращались, ничем не проявляя себя сотни лет.
Вирус натуральной оспы стал первым инфекционным носителем, который представлял действительную угрозу для человечества и от которого погибало большое количество людей. Свирепствовавшая в средние века оспа буквально выкашивала целые города, оставляя после себя огромные кладбища погибших. В 2007 году в журнале Национальной академии наук США (PNAS) вышла работа группы американских ученых — И. Дэймона и его коллег, — которым на основе геномного анализа удалось установить предположительное время возникновения вируса натуральной оспы: более 16 тысяч лет назад. Интересно, что в этой же статье ученые недоумевают по поводу своего открытия: как так случилось, что, несмотря на древний возраст вируса, эпидемии оспы не упоминаются в Библии, а также в книгах древних римлян и греков [9]?
Новосибирские микробиологи Игорь Бабкин и Ирина Бабкина из Института химической биологии и фундаментальной медицины РАН (ИХБФМ СО РАН), исходя из результатов геномного анализа называют более близкую к нам дату возникновения вируса натуральной оспы — 3000–4000 лет назад [8]. Место возникновения — восточная Африка. Но, так или иначе, вырвавшись с африканского континента около двух тысяч лет назад, вирус оспы начал свое «черное» шествие по миру, уложив в могилу огромное количество людей на всех континентах, и просуществовал до 1980 года, когда человечество объединенными усилиями его победило. Сегодня вирус натуральной оспы под строгим контролем сохраняется в двух лабораториях: в Центре по контролю заболеваний (CDC, Атланта, США) и в Научном центре вирусологии и биотехнологии «Вектор» (Кольцово, Россия) *.
* — Это официальные хранилища, а по поводу неофициальных спекулируют и обыватели, и авторитетные вирусологи, работающие под шефством ФБР. Так нужно ли уничтожать «легальные» образцы вирусов оспы? Почему ответ на этот вопрос неоднозначен, пытается разобраться американский журналист Ричард Престон в своей документальной книге «Демон в морозильной камере» [10]. Делает он это частично через призму событий, сопутствующих знаменитой рассылке писем со спорами сибиреязвенных бактерий в 2001 году («биомолекула» в одной из врезок затрагивала эту тему). Как реагировали всевозможные государственные структуры, как шаг за шагом продвигалось расследование ФБР, что творилось в недрах главного защитника населения США от биотеррористов — USAMRIID (Форт Детрик)... Автор описывает вирусы оспы и случаи, связанные с их «оживлением» и экспериментальным заражением животных, шпионские скандалы, последние вспышки натуральной оспы и историю глобальной победы над ней в конце 70-х. Однако Престон (как и некоторые компетентные герои его расследования) не страдает избытком оптимизма, небезосновательно считая, что мечта о тотальном избавлении от оспы не сбылась: хотя нам удалось истребить инфекцию в природе, «мы не смогли вырвать вирус из человеческого сердца». Основанием для этой мысли, помимо прочего, послужили сведения, подкрепляющие потенциальную возможность искусственного создания супервирусов оспы, а также... детская рука с типичными оспенными поражениями, найденная в 1999 году.
Страхи-страхами, а престонские демоны волей-неволей и на благо науки работают — по крайней мере, у нас. В конце 90-х в микробиологических кулуарах ходила байка о том, что кое-какие — не известные широкой общественности — биологические институты выжили благодаря содержимому своих холодильников: чиновников удалось «разжалобить» только страшилкой об апокалиптических последствиях отключения электроэнергии в институте. Ведь из размороженных холодильников всенепременно выскочат бациллы сибирской язвы! — Ред.
Строение вирусов и иммунный ответ организма
В поле зрения ученых вирусы попали в начале XVIII века. Тогда европейские врачи заинтересовались феноменом непроизвольной вакцинации: люди, зараженные легкой формой оспы — коровьей, — были не подвержены оспе натуральной, то есть человеческой. Прорыв в этом вопросе произошел в 1796 году, когда английский врач и ученый Эдвард Дженнер (рис. 1, справа) публично произвел первое «цивилизованное» и безопасное оспопрививание [11]. После этого прошло без малого двести лет, когда в 1892 году впервые был описан вирус. Звание первооткрывателя вирусов по праву принадлежит российскому микробиологу Дмитрию Иосифовичу Ивановскому (рис. 1, слева), который в конце XIX века сумел описать вирус, вызывающий мозаичную болезнь растения табака. И вслед за этим открытием началось лавинообразное изучение вирусов, которые не перестают нас удивлять и преподносить неожиданные сюрпризы.
Дмитрий Ивановский и Эдвард Дженнер
Рисунок 1. Первооткрыватель вирусов Д.И. Ивановский (1864–1920) (слева) и английский врач Эдвард Дженнер (справа).
После детального изучения вирусов, которые получили свое название от латинского слова virus (яд), стало известно, как именно они устроены. Полноценная вирусная частица — вирион — состоит из белковой оболочки (капсида) и внутреннего содержимого: нуклеиновой кислоты, «хранящей» вирусные гены (рис. 2, 3). У некоторых вирусов капсид покрыт дополнительными слоями из белков и липидов. По тому, какая именно нуклеиновая кислота содержится в вирусе, их делят на два больших вида: ДНК- и РНК-вирусы*.
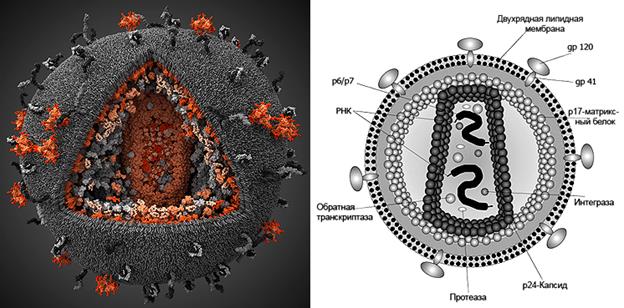
Рисунок 2. Строение вируса иммунодефицита человека (ВИЧ). Диаметр частицы ВИЧ составляет примерно 100–120 нм. gp120 — поверхностный белок, молекулы которого формируют «шляпку гриба». Именно этот белок взаимодействует с антителами и рецептором клетки-мишени (gp — гликопротеин, 120 — масса белка в дальтонах). gp41 — белок, формирующий «ножку гриба», встроенную в липидную мембрану вируса. р24 — внутренний белок, две тысячи молекул которого составляют капсид вируса (кор), имеющий форму усеченного конуса. р17 — матриксный белок, образующий слой толщиной 5–7 нм между внешней оболочкой и капсидом. Интеграза, ревертаза и протеаза — ферменты, необходимые для жизненного цикла вируса. РНК (2 копии) — хранилище генетической информации (ВИЧ — ретровирус). Генетический аппарат ВИЧ-1, связанный с нуклеокапсидным белком p7, имеет длину около 10 тыс. нуклеотидов и содержит девять генов. Рисунок с сайтов visual-science.com и «Википедии».
Почти все известные науке вирусы имеют свою специфическую мишень в живом организме — определенный рецептор на поверхности клетки, к которому и прикрепляется вирус. Этот вирусный механизм и предопределяет, какие именно клетки пострадают от инфекции. К примеру, вирус полиомиелита может прикрепляться лишь к нейронам и потому поражает именно их, в то время как вирусы гепатита поражают только клетки печени. Некоторые вирусы — например, вирус гриппа А-типа и риновирус — прикрепляются к рецепторам гликофорин А и ICAM-1, которые характерны для нескольких видов клеток. Вирус иммунодефицита избирает в качестве мишеней целый ряд клеток: в первую очередь, клетки иммунной системы (Т-хелперы, макрофаги), а также эозинофилы, тимоциты, дендритные клетки, астроциты и другие, несущие на своей мембране специфический рецептор СD-4 и CXCR4 -корецептор [13–15].
Что происходит после того, как вирус попадает внутрь организма? Уже в слизистой оболочке иммунные клетки (макрофаги) поглощают часть вирионов. Вслед за этим, когда вирус проникает в кровь, другие иммунные клетки — Т-хелперы — дают стимулирующий сигнал «убийцам» вирусов: B-лимфоцитам и Т-киллерам. Операция по уничтожению вируса переходит в следующую фазу. Активированные B-лимфоциты образуют антитела, которые находят свободные антигены вирусов и связываются с ними. Такой тандем (вирусный антиген — антитело) захватывается и уничтожается макрофагами. Те вирусы, которые сумели ускользнуть от антител и макрофагов и внедриться в клетки, уничтожаются вместе с пораженными клетками Т-киллерами. И завершающий этап иммунной реакции: клетки Т-супрессоры гасят активность иммунного ответа, прекращая агрессивные действия Т-киллеров и B-лимфоцитов, чтобы те, разбушевавшись, не уничтожили и здоровые клетки.
Одновременно с этим в организме реализуется еще один, молекулярный, защитный механизм: пораженные вирусом клетки начинают производить специальные белки — интерфероны, — о которых многие слышали в связи с гриппозной инфекцией. Существует три основных вида интерферонов. Синтез интерферона-альфа (ИФ-α) стимулируют лейкоциты. Он участвует в борьбе с вирусами и обладает противоопухолевым действием. Интерферон-бета (ИФ-β) производят клетки соединительной ткани, фибробласты. Он обладает таким же действием, как и ИФ-α, только с уклоном в противоопухолевый эффект. Интерферон-гамма (ИФ-γ) синтезируют Т-клетки (Т-хелперы и (СD8+) Т-лимфоциты), что придает ему свойства иммуномодулятора, усиливающего или ослабляющего иммунитет. Как именно интерфероны борются с вирусами? Они могут, в частности, блокировать работу чужеродных нуклеиновых кислот, не давая вирусу возможности реплицироваться (размножаться).
В 2008 году американские исследователи из Университета Рокфеллера открыли еще один интерферон-зависимый антивирусный механизм. Выяснилось, что интерферон стимулирует синтез белка BST-2 (тетерина), блокирующего выход вирионов из клетки [16]. Но некоторые вирусы научились обходить действие интерферона. Так, вирус Эбола (рис. 4) с помощью своего белка eVP24 не дает ядерному фактору PY-STAT1 проникнуть в ядро и запустить действие интерферона [17]. У этого вируса есть еще несколько механизмов, делающих его неуязвимым для иммунитета. Так, внутреннее содержимое вируса окружено «чехлом» из полисахаридов, благодаря чему вирус плохо распознается иммунной системой*.
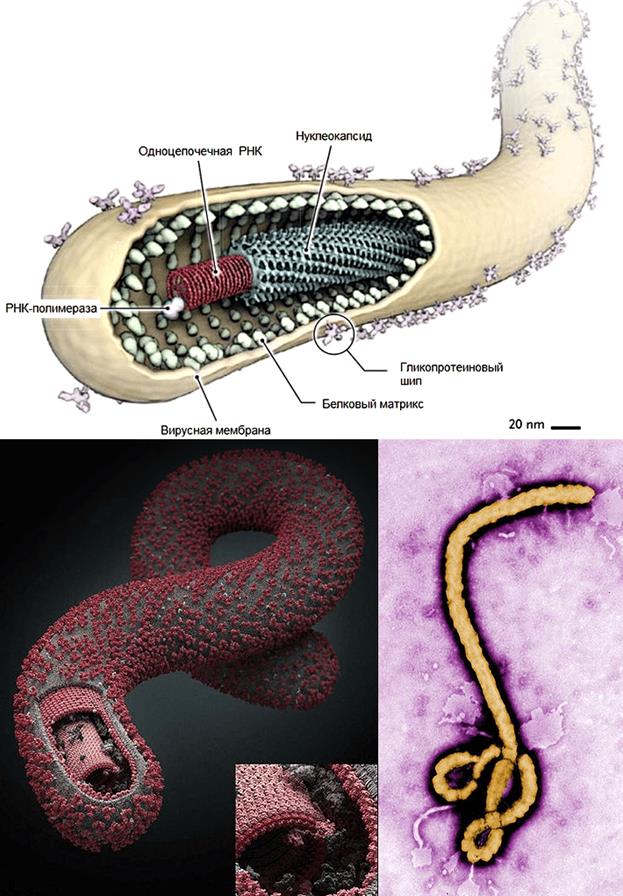
Рисунок 4. Схема строения, 3D-модель и фото вируса Эбола. Рисунки с сайтов www.visual-science.com и ebolaviruspictures.blogspot.com.
Существует одна схожая особенность многих опасных вирусов, затрудняющая вакцинацию и лечение: они чрезвычайно быстро меняются. У ВИЧ это обусловлено тем, что фермент обратная транскриптаза делает массу ошибок при копировании вируса в организме — такая у этого фермента особенность. И потому вирусные копии отличаются одна от другой, и вирус становится неуловимым. Это похоже на то, как если бы полиция искала преступника по фотороботу и отпечаткам, а он каждый день менял свой облик, да еще и делал себе двойников. У других вирусов есть свои механизмы изменчивости. К примеру, два знаменитых филовируса — Эбола и Марбурга — с момента открытия изменились по составу аминокислот в некоторых белках более чем на 20%! Вирус гриппа постоянно меняется благодаря двум своим специфическим особенностям: «антигенному дрейфу» и «антигенному шифту» — мутации антигенов вируса и полной замене одного из генов* [31].