Раствор – однородная система, состоящая из молекул растворителя и растворённого вещества, между которыми происходят физические и химические взаимодействия.
Раccмотрим схемы 1–2 и разберем, какие бывают растворы.
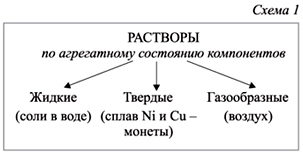

Какой из растворов вы предпочтете, готовя суп? Почему?
Определите, где разбавленный раствор, где концентрированный раствор медного купороса?
рис. 1
 рис. 2
рис. 2
Если в определённом объёме раствора содержится мало растворённого вещества, то такой раствор называют разбавленным, если много – концентрированным.




Определите, где какой раствор?
Не следует смешивать понятия «насыщенный» и «концентрированный» раствор, «ненасыщенный» и «разбавленный» раствор.
Одни вещества хорошо растворяются в воде, другие мало, а третьи – не растворяются совсем. Посмотрите видео "РАСТВОРИМОСТЬ ТВЁРДЫХ ВЕЩЕСТВ В ВОДЕ"
Выполните задание в тетради: Распределите предложенные вещества - СO2, H2, O2, H2SO4, Уксус, NaCl, Мел, Ржавчина, Растительное масло, Спирт в пустые столбики таблицы 1, используя свой жизненный опыт.
Таблица 1
| Растворенное вещество | Примеры веществ | |
| Растворимые | Малорастворимые | |
| Газ | ||
| Жидкость | ||
| Твердое вещество |
Проверка
А можете ли вы сказать о растворимости FeSO4?
Как же быть?
Для того чтобы определить растворимость веществ в воде, мы будем пользоваться таблицей растворимости солей, кислот и оснований в воде. Она находится в приложениях к уроку.
В верхней строке таблицы – катионы, в левом столбце – анионы; ищем точку пересечения, смотрим букву – это и есть растворимость.
| Н – нерастворимые вещества (меньше 0,01 г в 100 г воды), М – малорастворимые (0,01–10 г в 100 г воды), Р – растворимые (более 10 г в 100 г воды). |
Определим растворимость солей: AgNO3, AgCl, CaSO4.
Растворимость увеличивается с ростом температуры (бывают исключения). Вы прекрасно знаете, что удобнее и быстрее растворять сахар в горячей, а не в холодной воде. Посмотрите "Тепловые явления при растворении"
Попробуйте сами, пользуясь таблицей, определить растворимость веществ.
Задание. Определить растворимость следующих веществ: AgNO3, Fe(OH)2, Ag2SO3, Ca(OH)2, CaCO3, MgCO3, KOH.
ОПРЕДЕЛЕНИЯ по теме «Растворы»
Раствор – однородная система, состоящая из молекул растворителя и растворённого вещества, между которыми происходят физические и химические взаимодействия.
Насыщенный раствор – это раствор, в котором данное вещество при данной температуре больше не растворяется.
Ненасыщенный раствор - это раствор, в котором при данной температуре вещество ещё может растворяться.
Суспензией называют взвесь, в которой мелкие частицы твёрдого вещества равномерно распределены между молекулами воды.
Эмульсией называют взвесь, в которой мелкие капельки какой-либо жидкости распределены между молекулами другой жидкости.
Разбавленные растворы - растворы с небольшим содержанием растворенного вещества.
Концентрированные растворы - растворы с большим содержанием растворенного вещества.
ДОПОЛНИТЕЛЬНО:
По соотношению преобладания числа частиц, переходящих в раствор или удаляющихся из раствора, различают растворы насыщенные, ненасыщенные и пересыщенные. По относительным количествам растворенного вещества и растворителя растворы подразделяют на разбавленные и концентрированные.
Раствор, в котором данное вещество при данной температуре больше не растворяется, т.е. раствор, находящийся в равновесии с растворяемым веществом, называют насыщенным, а раствор, в котором еще можно растворить добавочное количество данного вещества, - ненасыщенным.
Насыщенный раствор содержит максимально возможное (для данных условий) количество растворенного вещества. Следовательно, насыщенным раствором является такой раствор, который находится в равновесии с избытком растворенного вещества. Концентрация насыщенного раствора (растворимость) для данного вещества при строго определенных условиях (температура, растворитель) - величина постоянная.
Раствор, содержащий растворенного вещества больше, чем его должно быть в данных условиях в насыщенном растворе, называется пересыщенным. Пересыщенные растворы представляют собой неустойчивые, неравновесные системы, в которых наблюдается самопроизвольный переход в равновесное состояние. При этом выделяется избыток растворенного вещества, и раствор становится насыщенным.
Насыщенный и ненасыщенный растворы нельзя путать с разбавленным и концентрированным. Разбавленные растворы - растворы с небольшим содержанием растворенного вещества; концентрированные растворы - растворы с большим содержанием растворенного вещества. Необходимо подчеркнуть, что понятие разбавленный и концентрированный растворы являются относительными, выражающими только соотношение количеств растворенного вещества и растворителя в растворе.