Электрокоагуляция - теоретические основы процесса.
Электрокоагуляция – это выделение из воды Cr6+ и ионов тяжёлых металлов.
При проходе сточных вод через межэлектродное пространство происходит электролиз, поляризация частиц, окислительно-восстановительные реакции и взаимодействие продуктов электролиза.
Основное условие успешного протекания процесса электрокоагуляции – применение растворимых электродов из металлов с большИм отрицательным потенциалом: сталь или аллюминий.
Под действием тока происходит растворение металла, следовательно, в воду переходят катионы Fe или Al, которые встречаясь с гидроксо-группами OH- образуют гидроксиды металлов в виде хлопьев в следствии интенсивной коагуляции.
Соединение Cr6+ присутствует в сточной воде, Cr2O7 – восстановливается электрокоагуляторами с катионами Fe2+ - происходит растворение стальных анодов по реакциям:
Fe0 - 2ē → Fe2+ ;
Cr2O72- + 6Fe2+ + 14H+ → 2Cr3+ + 6Fe3+ + 7H2O;
Cr3+ + OH- → Cr(OH)3 ↓;
Fe3+ + OH- → Fe(OH)3 ↓.
Важно контролировать конечные значения pH обрабатываемой воды – значение должно быть меньше 5,5 pH, иначе не достигается достаточно полное осаждение Cr(OH)3 и в воде остаются ионы Cr.
Теоретически определено, что растворение 1г Al эквивалентно введению в воду 12,3г Al2(SO4)3 на 18 молекул H2О;
На 1г Fe – 4,9г FeSO4 на 7 молекул H2O.
Количество металла на аноде в результате электролиза определяется по уравнению Фарадея:
C = η · A · Y · t / n · F
А – молярная масса металла, г · моль;
Y – сила тока, А;
t – время прохождения тока, сек;
η (эта) – выход металла по току – КПД;
F – число Фарадея, A · сек / г · кмоль.
Необходимый расход Fe определяется по формуле:
G = d · C · Q
d – удельный расход Fe на удаление определённого загрязняющего вещества;
|
|
C – исходная концентрация ионов металла;
Q – расход сточных вод.
Полезный объём ванны электрокоагулятора определяется по формуле:
Vполезн = Q · t
Электродиализ - теоретические основы процесса.
Электродиализ – это процесс удаления из растворов ионизированных веществ (веществ в ионном виде) путём переноса их через мембрану в поле постоянного электрического тока.
При этом процессе возникает направленное движение ионов, в основном растворимых солей, H+, OH-.
Катионы движутся к катоду, анионы – к аноду.
При достижении катода катионы восстанавливают ионизированные вещества в соответствии с реакцией:
2H+ + 2 ē → H2 ↑;
4OH- + 4 ē → O2 ↑ + 2H2O;
2Cl - 2 ē → Cl2 ↑.
Аппарат электродиализа – это камера с отсеками, разделёнными мембранами, которые проницаемы для катионов только с одной стороны, а для анионов только с другой (рис. 1).
Количество отсеков всегда нечётное.
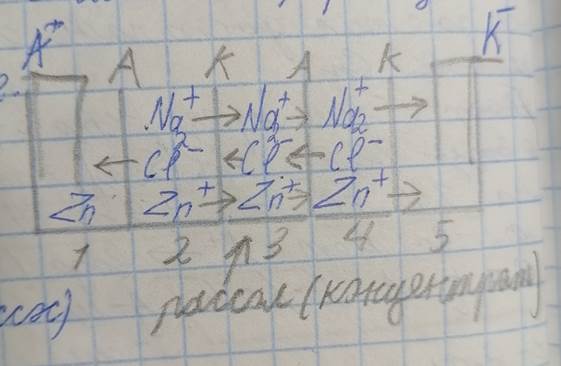
Рис. 1 - схема аппарата электродиализа.
А+ - анод;
К- - катод;
А – мембрана, пропускающая только анионы;
К – мембрана, пропускающая только катионы;
(Стрелка пересекает мембрану – ион проходит через неё);
(Стрелка не пересекает мембрану – ион не проходит через неё);
2, 4 – камеры с очищенной водой;
3 – камера с концентратом (рассолом) – всеми загрязняющими веществами.
Формула определения количества электричества, затраченного на обессоливание:
Y · t = F · (Сп – Ск) · V/ η
Cп – исходная концентрация загрязняющих веществ, г · экв/л;
Cк – конечная концентрация загрязняющих веществ, г · экв/л;
|
|
V – объём воды в камерах обессоливания;
η (эта) – КПД – определяется тем, что часть электричества расходуется на электродные процессы выделения Cl на аноде и H+ на катоде, а также нагревание воды.
При отрицательных значениях Y · t образуется высокая концентрация рассола.
Механизм и теоретические основы обратного осмоса.
Обратный осмос – это метод опреснения, основанный на фильтровании солёной воды через полупроницаемую мембрану, пропускающую воду, но задерживающую гидратированные ионы (ионы, связанные с молекулами воды) растворённых солей в воде.
Осмос – это стремление системы к химическому равновесию (рис. 1).

Рис. 1 – схема процесса осмоса
1 – чистая вода;
2 – солёная вода;
3 – мембрана (с порами размеров молекул H2O).
Чистая вода переходит из камеры 1 в камеру 2 до тех пора, пока уровень воды в камере 2 не уравновисится давлением, созданным столбом жикости – h (рис. 2). В результате чего достигается осмотическое равновесие.
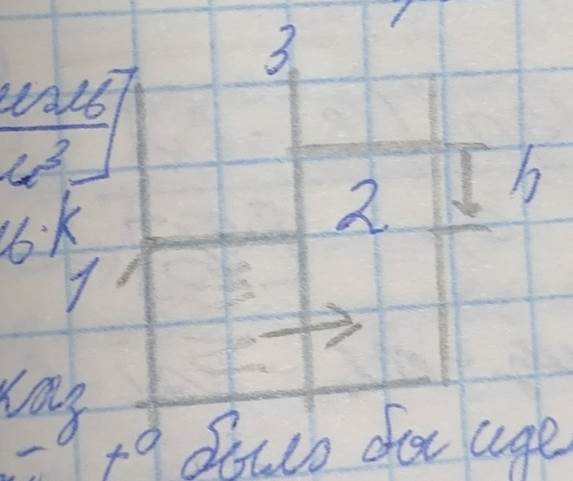
Рис. 2 – Схема достижения осмотического равновесия
1 – чистая вода;
2 – солёная вода;
3 – мембрана.
Величина осмотического давления π, которая зависит от разности концентраций ионов в растворах, находящегося по обе стороны мембраны, по закону Вант-Гоффа:
π = ΔC·R·T
C – разность концентраций ионов по обе стороны мембраны, моль/м3;
R – универсальная газовая постоянная = 8,34 Дж/моль·К;
T – температура, К – разница температура на выходе и на входе;
Осмотическое давление численно равно давлению, которое оказывало бы растворённое вещество, если бы при данной температуре было бы идеальным газом с объёмом, равным объёму раствора.
|
|
При разности концентраций раствора соответствующих океанической (солесодержание = 35 г/л) и дистиллированной воде (солесодержание = 0 г/л):
π = 2,5 Мпа.
Чтобы опреснить воду в процессе обратного осмоса, нужно, создавая избыточное давление, заставить воду фильтроваться через мембрану в направлении, противоположному осмотическому переносу, то есть со стороны солёной воды в сторону очищенной воды.
Чтобы получить удовлетворительную скорость фильтрования, нужно приложить давление, намного превосходящее осмотическое давление π концентрата. Тогда из солёной воды через мембрану начнут выходить молекулы пресной воды (рис. 3).
P >> π, процесс обратного осмоса эффективен, если приложенное давление превышает осмотическое в 1,5 – 2 раза.
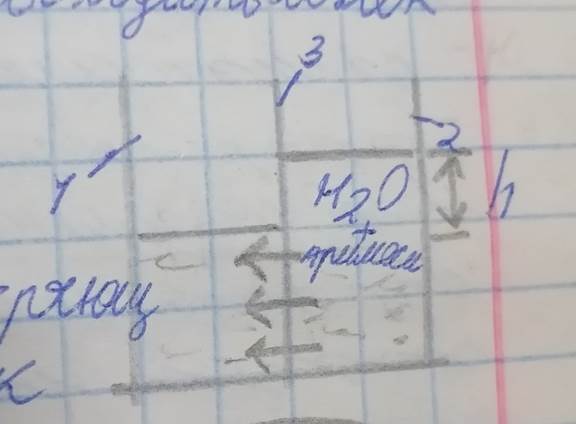
Рис. 3 – Схема процесса обратного осмоса
1 – чистая вода;
2 – солёная вода (вода с примесями);
3 – мембрана.