Муниципальный этап всероссийской олимпиады школьников по химии
Учебный год
Класс
ЗАДАНИЕ 1 (ТЕСТ)
Вам предложены задания с выбором ответа (в каждом задании только один ответ правильный). Выберите верный ответ.
1. Изомерами являются:
А) этан и метан Б) хлорметан и дихлорметан
В) этан и этен Г) бутен и циклобутан
2. При взаимодействии пропанола-1 с хлоридом натрия в присутствии серной кислоты образуется:
А) пропилен Б) 1- хлорпропан
В) 2 - хлорпропан Г) 2 - хлорпропен
3. Глицерин способен взаимодействовать в присутствии щелочи с:
А) метаном Б) бензолом
В) гидроксидом меди (II) Г) хлоридом железа (II)
4. В 5 л пропана содержится столько же атомов водорода, сколько их содержится в:
А) 6 л этана Б) 8 л метана В) 4 л бутана Г) 3 л пентана
5. В одном из оксидов массовая доля кислорода составляет 60%. Этот оксид:
А) серы Б) фосфора В) магния Г) кальция
6. Появление капель воды при пропускании газа в пробирку, в которой нагревают порошок чёрного цвета, можно объяснить реакцией:
А) водорода с углем Б) водорода с оксидом кальция
В) оксида меди с хлороводородом Г) оксида меди с водородом
7. Электронную конфигурацию катиона кальция имеет ион:
А) F- Б) Mg2+ В) Cl- Г) Al3+
8. Найдите неверное утверждение:
А) смесь веществ, состоящая из ионов Сa2+, Fe3+,Br– растворима в воде
Б) смесь веществ, содержащая ионы Al3+, Na+, OH– растворима в растворе гидроксида натрия
В) раствор, содержащий ионы K+, Na+,  имеет слабощелочную среду
имеет слабощелочную среду
Г) раствор, содержащий ионы Na+,  ,
,  , имеет слабощелочную среду
, имеет слабощелочную среду
9. Наибольший объем водорода выделится при взаимодействии:
А) 6,5 г цинка с избытком соляной кислоты
Б) 2,7 г алюминия с избытком раствора щелочи
В) 2,4 г магния с избытком раствора серной кислоты
Г) 4 г кальция с избытком воды
10. «Тогда услышал я (о, диво!), запах скверный,
Как будто тухлое разбилося яйцо,
Или карантинный страж курил жаровней серной.
Я, нос, себе зажав, отворотил лицо…»
А.С.Пушкин
О каких веществах упоминает А.С. Пушкин в четверостишье?
А) аммиак и фосфин Б) фосфин и сероводород
В) сероводород и сернистый газ Г) сернистый газ и аммиак
ЗАДАНИЕ 2
Приведите уравнения реакций, соответствующих схеме превращений:
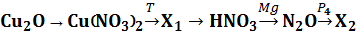
Для четвертого уравнения составьте схему электронного баланса. Укажите окислитель, восстановитель. Назовите вещество Х2 (газ).
ЗАДАНИЕ 3
Напишите уравнения реакций, соответствующие следующей последовательности превращений:

Назовите неизвестные вещества А – Е.
ЗАДАНИЕ 4
При нагревании образца карбоната бария часть вещества разложилась. При этом выделилось 1,12 л газа (н.у.). Масса твердого остатка составила 27,35 г. Этот остаток добавили к 73 г 30%-го раствора соляной кислоты. Определить массовую долю кислоты в полученном растворе.
ЗАДАНИЕ 5
Закончите уравнение реакции, определив недостающие вещества. Поставьте коэффициенты, определите окислитель и восстановитель:
NaClO3 + MnO2 + … → Na2MnO4 + … + H2O
ЗАДАНИЕ 6
ЭКСПЕРИМЕНТАЛЬНОЕ ЗАДАНИЕ
(выполняется в лаборатории на практике)
В пробирках без надписей даны этанол, глицерин, растворы уксусной кислоты, глюкозы, белка куриного яйца.
Опытным путем определите, в какой пробирке находится каждое вещество, используя только один реактив: гидроксид натрия (раствор) и сульфат меди (II) (раствор). Составьте уравнения реакций, указав условия их проведения, и отразите свои наблюдения.