МОЛЕКУЛЯРНАЯ ФИЗИКА И ТЕРМОДИНАМИКА
Методические указания к выполнению
Рассчетно-графического задания
По физике №2
Иваново 2008
Составители: В.Х. Костюк,
О.А. Кабанов,
Г.А. Шмелева
Редактор В.К. Ли-Орлов
Содержат математические формулировки основных определений и законов молекулярной физики и термодинамики с пояснениями, примеры решений типовых задач, образцы оформления решений, задания для самостоятельной работы студентов по курсу "Молекулярная физика и термодинамика". Предназначены для обеспечения самостоятельной работы студентов.
Утверждены цикловой методической комиссией инженерно-физического факультета.
Рецензент
кафедра физики ГОУВПО "Ивановский государственный энергетический университет имени В.И. Ленина"
Молекулярная физика и термодинамика
Методические указания к выполнению расчетно-графического задания по физике №2
Составители: КОСТЮК Владимир Харитонович,
КАБАНОВ Олег Альбертович,
ШМЕЛЕВА Галина Александровна
Редактор М.А. Иванова
Лицензия ИД № 05285 от 4 июля 2001 года
Подписано в печать Формат 60х84  .
.
Печать плоская. Усл. печ. л. 2,79. Тираж 150 экз. Заказ №
ГОУВПО "Ивановский государственный энергетический университет имени В.И. Ленина"
Отпечатано в РИО ИГЭУ
153003, г. Иваново, ул. Рабфаковская, 34.
Программа курса
"Молекулярная физика и термодинамика"
Термодинамические системы. Методы молекулярной физики, статистической физики и термодинамики. Термодинамические параметры. Состояния термодинамической системы. Уравнения состояния идеального газа. Термодинамические процессы. Диаграммы состояний и процессов.
|
|
Основное уравнение молекулярно-кинетической теории идеального газа. Средняя кинетическая энергия молекул. Абсолютная температура. Число степеней свободы молекулы. Закон равномерного распределения энергии по степеням свободы молекул. Распределение молекул идеального газа по скоростям – распределение Максвелла. Барометрическая формула. Распределение молекул идеального газа по энергиям в потенциальном поле – распределение Больцмана.
Термодинамика идеального газа. Термодинамические функции: внутренняя энергия, работа, количество теплоты. Первый закон термодинамики. Работа в изохорном, изобарном и изотермическом процессах. Теплоемкость. Теплоемкость идеального газа. Соотношение Майера. Адиабатный процесс. Уравнение Пуассона.
Циклические процессы. Цикл Карно. Тепловая машина. КПД тепловой машины. КПД идеальной тепловой машины. Теорема Карно.
Обратимые и необратимые процессы. Второй закон термодинамики. Энтропия. Теорема Нернста. Энтропия идеального газа. Понятия порядка и беспорядка. Статистический вес. Формула Больцмана. Статистический смысл второго закона термодинамики.
Кинетические явления. Среднее число столкновений и средняя длина свободного пробега молекул. Диффузия, теплопроводность и внутреннее трение.
Реальные газы. Уравнение Ван-дер-Ваальса. Изотермы реального газа. Фазовые переходы 1-го рода. Критическое состояние вещества.
I. УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗА
ПРОЦЕССЫИДЕАЛЬНОГО ГАЗА
1. Уравнения состояния идеального газа (производные формы):
 ,
,
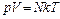 ,
,
|
|
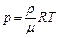 ,
,
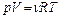 ,
,
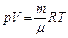 ,
,
где р – давление;
n – концентрация молекул;
k = 1,38 10-23 Дж/К; – постоянная Больцмана;
T – абсолютная температура;
V – объём;
N – число молекул;
ρ – плотность газа;
μ – молярная масса;
m – масса газа;
ν – число молей;
R = 8,31 Дж/(моль·К) – универсальная газовая постоянная.
2. Закон Дальтона:
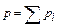 ,
,
где p – давление смеси газов, pi – парциальное давление i – го компонента смеси газов.
3. Термодинамические процессы в идеальном газе постоянной массы:
а) изотермический, Т = const, 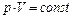 ;
;
б) изобарный, p= const, 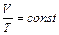 ;
;
в) изохорный, V = const, 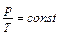 .
.
Примеры решения задач
 Задача 1. В баллоне объёмом 20 л находится аргон под давлением 1,0 МПа и температуре 300 К. После того как из баллона было взято 20,0 г аргона, температура в баллоне понизилась до 280 К. Определить давление газа, оставшегося в баллоне.
Задача 1. В баллоне объёмом 20 л находится аргон под давлением 1,0 МПа и температуре 300 К. После того как из баллона было взято 20,0 г аргона, температура в баллоне понизилась до 280 К. Определить давление газа, оставшегося в баллоне.
Дано: Решение:
 V = 20 л = 2,0·10-2 м3 Для решения задачи воспользуемся
V = 20 л = 2,0·10-2 м3 Для решения задачи воспользуемся
р1 = 1,0 МПа = 1,0·106 Па уравнением состояния идеального
Т1 = 300 К газа, применив его к начальному и
Т2 = 280 К конечному состояниям газа:
 Δm = 20,0 г = 2,0·10-2 кг
Δm = 20,0 г = 2,0·10-2 кг  , (1)
, (1)
р2 –? 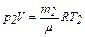 . (2)
. (2)
Из уравнений (1) и (2) выразим m1 и m2 и найдём их разность:
 ,
,
откуда находим
 . (3)
. (3)
Проверку решения проведем по размерности физических величин. В правую часть вместо символов величин подставим их единицы измерения. В правой части два слагаемых. Первое из них имеет размерность давления, так как состоит из двух множителей, первый из которых – давление, а второй – безразмерный. Проверим второе слагаемое:
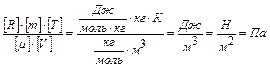 .
.
Вычисления произведём по формуле (3) с учётом, что для аргона 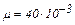 кг/моль.
кг/моль.
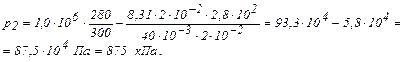 Ответ: 875 кПа.
Ответ: 875 кПа.
Задача 2. В сосуде находится смесь 14,0 г азота и 16,0 г кислорода при температуре 300 К и давлении 8,3 кПа. Определить плотность этой смеси, считая газы идеальными.
|
|
Дано: Решение:

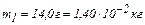 Для каждого компонента в смеси
Для каждого компонента в смеси
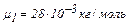 газов можно записать уравнения
газов можно записать уравнения
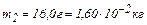 состояния:
состояния:
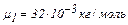
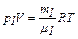 , (1)
, (1)
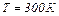

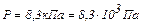
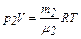 . (2)
. (2)
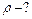
Давление смеси равно  (по закону Дальтона). Суммируя (1) и (2), с учётом закона Дальтона найдём объём газа
(по закону Дальтона). Суммируя (1) и (2), с учётом закона Дальтона найдём объём газа
 .
.
Для плотности смеси находим
 .
.
Проверка размерности:

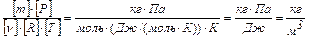 .
.
Вычисления:
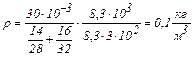 .
.
Ответ: 0,1 кг/м3.
Задача 3. Поршневым воздушным насосом откачивают баллон объёмом 10,0 л. За один цикл (ход поршня) насос захватывает объём 0,4 л. Через сколько циклов давление в баллоне уменьшится от 0,1 МПа до 0,1 кПа? Процесс считать изотермическим, газ – идеальным.
 Дано: Решение:
Дано: Решение:
V = 10 л = 1,0 10-2 м3 Для изотермического процесса в первом
ΔV = 0,4 л = 0,4 10-3 м3 и следующих циклах можно записать
р0 = 0,1 МПа = 1,0 105 Па 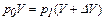 ,
,
рN = 0,1 кПа = 100 Па 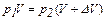 ,
,
Т = const -----------------------
 N –?
N –?  .
.
Получаем рекуррентную формулу
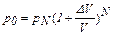 , (1)
, (1)
где N – число циклов. Прологарифмировав соотношение (1), получим для числа циклов
 . (2)
. (2)
Правая часть (2) содержит отношения однородных величин и является безмерной.
Вычисления:
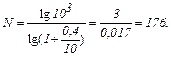
Ответ: 176 циклов.
Задача 4. Идеальный газ совершает процесс, в котором давление изменяется в зависимости от объёма по закону p=p0–αV2, где p0=0,1 МПа, α=1,0·107 Па·моль2/м6. Количество вещества газа равно 1 моль. Определить максимальную температуру газа в процессе.
Дано: Решение:
 р = р0 – αV2 Найдём зависимость
р = р0 – αV2 Найдём зависимость 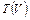 . Для этого
. Для этого
р0= 0,1 МПа = 105 Па воспользуемся уравнением состояния для
α = 1,0·107 Па·моль2/м6 одного моля газа

Тmax –? 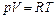 .
.
Исключая давление, получим
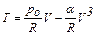 . (1)
. (1)
Из условий

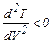
находим максимум функции T(V). Получается, что в области положительных значений V и Т зависимость (1) при объёме моля газа
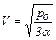
имеет максимальную температуру, равную
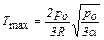 .
.
Проверка размерности:
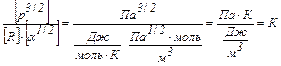 .
.
Вычисления:
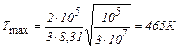 .
.
Ответ: 465 К.