Получение серебра
В природе встречается в виде минерала аргентита Ag2S

В настоящее время для получения серебра применяется цианидное выщелачивание. При этом образуются растворимые в воде его комплексные цианиды:
Ag2S + 4NaCN = 2Na[Ag(CN)2] +Na2S.
Чтобы сместить равновесие вправо, через него пропускают воздух. Сульфид-ионы при этом окисляются до тиосульфат-ионов (ионов S2O32–) и сульфат-ионов (ионов SO42–).
Из цианидного раствора Ag выделяют цинковой пылью:
2Na[Ag(CN)2] + Zn = Na2[Zn(CN)4] + 2Ag.
Для получения серебра очень высокой чистоты (99,999%) его подвергают электрохимическому рафинированию в азотной кислоте или растворению в концентрированной серной кислоте. При этом серебро переходит в раствор в виде сульфата Ag2SO4. Добавление меди или железа вызывает осаждение металлического серебра:
Ag2SO4 + Cu = 2Ag + CuSO4.
Серебро, будучи благородным металлом, отличается относительно низкой реакционной способностью, оно не растворяется в соляной и разбавленной серной кислотах. Однако в окислительной среде (в азотной, горячей концентрированной серной кислоте, а также в соляной кислоте в присутствии свободного кислорода) серебро растворяется:

3Ag + 4HNO3 (30%-ная) = 3AgNO3 + NO + 2H2O.
2Ag + 2H2SO4 (конц.) = Ag2SO4 + SO2 + 2H2O.
В царской водке серебро не растворяется из-за образования защитной пленки AgCl. В отсутствие окислителей при обычной температуре НCl, HBr, HI также не взаимодействуют с ним благодаря образованию на поверхности металла защитной пленки малорастворимых галогенидов.
Растворяется оно и в хлорном железе, что применяется для травления:

Серебро также легко растворяется в ртути, образуя амальгаму (жидкий сплав ртути и серебра).
Серебро не окисляется кислородом даже при высоких температурах, однако в виде тонких плёнок может быть окислено кислородной плазмой или озоном при облучении ультрафиолетом. Во влажном воздухе в присутствии даже малейших следов двухвалентной серы (сероводород, тиосульфаты, резина) образуется налёт малорастворимого сульфида серебра, обуславливающего потемнение серебряных изделий:


С водородом, азотом и углеродом серебро непосредственно не взаимодействует. Фосфор действует на него лишь при температуре красного каления с образованием фосфидов. При нагревании с серой Ag легко образует сульфид Ag2S.
Образует комплексы, в особенности в реакциях с цианидами натрия и калия:
4Ag + 8KCN + 2H2O + О2= 4K[Ag(CN)2] + 4KOH
СТЕПЕНЬ ОКИСЛЕНИЯ +1
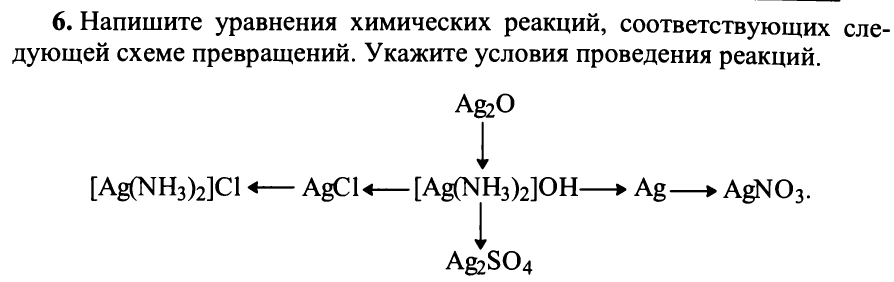
Наиболее устойчивой степенью окисления серебра в соединениях является +1. В присутствии аммиака соединения серебра (I) дают легко растворимый в воде комплекс [Ag(NH3)2]+. Серебро образует комплексы также с цианидами, тиосульфатами. Комплексообразование используют для растворения малорастворимых соединений серебра, для извлечения серебра из руд. Более высокие степени окисления (+2, +3) серебро проявляет только в соединении с кислородом (AgO, Ag2O3) и фтором (AgF2, AgF3), такие соединения гораздо менее устойчивы, чем соединения серебра (I).
Соли серебра (I), за редким исключением (нитрат, перхлорат, фторид), нерастворимы в воде, что часто используется для определения ионов галогенов (хлора, брома, йода) в водном растворе.
При добавлении щелочи к растворам солей серебра в осадок выпадает оксид Ag2O, так как гидроксид AgOH неустойчив и разлагается на оксид и воду:
2AgNO3 + 2NaOH = Ag2O + 2NaNO3 + H2O
При нагревании оксид Ag2O разлагается на простые вещества:
2Ag2O = 4Ag + O2
С перекисью водорода Ag2O взаимодействует при комнатной температуре:
Ag2O + H2O2 = 2Ag + H2O + O2.


Соли серебра.
Характерной особенностью солей серебра, как и других элементов побочных подгрупп I группы, является способность образовывать комплексные соединения с аммиаком, цианидами щелочных металлов и тиосульфатом натрия:
AgCl+2NH3+H2O=[Ag(NH3)2]OH+НСl
AgBr+2KCN=K[Ag(CN)2]+KBr
2Na2S2O3+AgCl=Na3[Ag(S2O3)2]+NaCl






Ломоносов 2011

МГУ, синий сборник Вариант М-96-1 стр.172


Год
 2016
2016

МГУ-школе. Химический факультет. СО-2006-1




ФМБ-2006-2

ПБ-2006-1




 ФХБ-2007-1
ФХБ-2007-1 
 СО-2008-2
СО-2008-2


 ББЗК-08-03
ББЗК-08-03