1. Первый закон термодинамики:
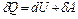 ,
,
где δ Q – элементарное количество теплоты, сообщенное термодинамической системе;
dU – бесконечно малое изменение внутренней энергии термодинамической системы;
δA – элементарная работа, совершенная термодинамической системой.
2. Количество теплоты, полученное или отданное системой в процессе,
 ,
,
где T1 и T2 – температуры начального и конечного состояния газа;
v – количество молей газа;  – молярная теплоемкость газа в процессе.
– молярная теплоемкость газа в процессе.
3. Внутренняя энергия идеального газа
 .
.
Изменение внутренней энергии идеального газа в процессе:
 .
.
4. Элементарная работа газа (работа газа при равновесном, бесконечно малом изменении объема)
 .
.
Работа газа в процессе
 ,
,
где V1 и V2 – объемы начального и конечного состояния газа.
5. Теплоемкости идеального газа при постоянном объеме и постоянном давлении:
 ,
,  .
.
6. Соотношение Майера:
 .
.
7. Уравнение адиабатного (происходящего без теплообмена) процесса:
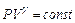 ,
,
где  – коэффициент Пуассона.
– коэффициент Пуассона.
8. Уравнение политропного (происходящего при постоянной теплоемкости) процесса:
 ,
,
где n – показатель политропы.
Примеры решения задач
Задача 1. Газообразный водород, находившийся при нормальных физических условиях в закрытом сосуде объемом 5,0 л, охладили на 55 К. Определить приращение внутренней энергии газа и количество отданного им тепла.
Дано: Решение:
 ро= 105 Па Первый закон термодинамики:
ро= 105 Па Первый закон термодинамики:
То= 273 К  . (1)
. (1)
Vo= 5,0·10-3 м3 Для изохорного процесса работа газа
 ∆Т = – 55 К
∆Т = – 55 К  . (2)
. (2)
Q, ∆E –?
Изменение внутренней энергии идеального газа
 . (3)
. (3)
Уравнение состояния идеального газа:
 . (4)
. (4)
Решая систему уравнений (1) – (4), получаем
 .
.
Для молекулярного водорода число степеней свободы молекулы i=5.
Проверка размерности:
 .
.
Вычисления:
 .
.
Ответ: 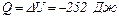 .
.
Задача 2. Три моля идеального газа при температуре 300 К изотермически расширили в 4 раза, а затем изохорно нагрели так, что его давление стало равно первоначальному. За весь процесс газу сообщили количество теплоты 67 кДж. Определить коэффициент Пуассона для этого газа.
 Дано: Решение:
Дано: Решение:
Т1= 300 К В процессе изотермического расширения
 газа из состояния
газа из состояния  в состояние
в состояние
Q= 6,7·104 Дж  к газу подводится теплота
к газу подводится теплота


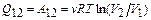 .
.
В процессе изохорного нагрева к газу подводится количество теплоты

Для нахождения T3 воспользуемся уравнениями изохорного и изотермического процессов:
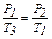 ,
,  .
.
Для T3 получим  .
.
Коэффициент Пуассона связан с числом степеней свободы молекулы
газа соотношением  .
.
Из этого выражения следует, что  .
.
Для 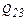 окончательно получаем
окончательно получаем
 .
.
При переходе газа из состояния I в состояние III затрачивается количество теплоты
 . (1)
. (1)
Из (1) выразим коэффициент Пуассона
 .
.
Убедимся, что соотношение  является безразмерной величиной:
является безразмерной величиной:
 .
.
Вычисления:
 .
.
Ответ: 1,4.
Задача 3. Объем одного моля идеального газа с коэффициентом Пуассона γ = 5/3 изменяют по закону VT = a, где а – положительная константа. Определить количество теплоты, полученное газом в этом процессе, если его температура возросла на 60 К.
 Дано: Решение:
Дано: Решение:
 Первый закон термодинамики:
Первый закон термодинамики:
ν = 1 моль 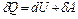 . (1)
. (1)
∆Т = 60 К Бесконечно малое изменение внутренней энергии


 . (2)
. (2)
Элементарная работа  . (3)
. (3)
Перепишем первый закон термодинамики, выразив изменения термодинамических функций через изменения термодинамических параметров, т.е. подставим уравнения (2) и (3) в уравнение (1):
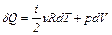 . (4)
. (4)
Выразим уравнение процесса в параметрах P и V. Для этого воспользуемся уравнением состояния газа и уравнением процесса, данным в условии задачи:
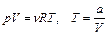 .
.
Исключая температуру, получим
 . (5)
. (5)
Выразим число степеней свободы через коэффициент Пуассона:
 . (6)
. (6)
Подставляя уравнения (5) и (6) в уравнение (4) приходим к выражению
 . (7)
. (7)
Интегрируя (7), получаем
 .
.
Проверка размерности:
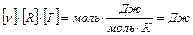 .
.
Вычисления:
 .
.
Ответ: 0,25 кДж.
Задача 4. Определить молярную теплоемкость идеального газа в политропном процессе 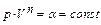 , если n = 3, а коэффициент Пуассона этого газа γ = 5/3.
, если n = 3, а коэффициент Пуассона этого газа γ = 5/3.
 Дано: Решение:
Дано: Решение:
n = 3 Первый закон термодинамики:
γ = 5/3 
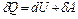 . (1)
. (1)
 Выразив изменения термодинамических функций через изменения термодинамических параметров,
Выразив изменения термодинамических функций через изменения термодинамических параметров,
 ,
,  ,
,  ,
,
и подставив их в уравнение (1), получаем
 . (2)
. (2)
Выразив давление из уравнения процесса, данного в условии, и подставив в уравнение (2), получаем
 . (3)
. (3)
Определим производную  . Для этого воспользуемся уравнениями политропического процесса и состояния идеального газа и выразим уравнение процесса в параметрах V и T:
. Для этого воспользуемся уравнениями политропического процесса и состояния идеального газа и выразим уравнение процесса в параметрах V и T:
 . (4)
. (4)
Дифференцируя (4), получаем  и подставляем в (3):
и подставляем в (3):
 .
.
Проверка размерности:
 .
.
Предельные случаи:
1) при n = 0 получаем р = const, т.е. теплоемкость дли изобарного процесса Cμn = Cμp;
2) при n = γ получаем S = const, т.е. теплоемкость адиабатного процесса Cμn = 0.
Вычисления: 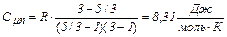 .
.
Ответ:  .
.