Основной причиной коррозии металлов является их термодинамическая неустойчивость в коррозионноактивной среде. Мерой термодинамической неустойчивости служит изменение энергии Гиббса (ΔG), наблюдаемое при взаимодействии металла с электролитом:
∆G = – n·F·∆φр
где n – число электронов, участвующих в электрохимическом процессе;
F – число Фарадея (96485 Кл/экв);
∆φр = (φрк – φра) – разность потенциалов катодной φрк и анодной φра реакций.
Термодинамический коррозионный процесс возможен лишь при ΔG<0 поэтому ∆φр>0, следовательно φрк> φра. Это означает, что электрохимическая коррозия металла будет происходить, если в растворе присутствует достаточно активный окислитель, равновесный потенциал которого положительнее равновесного потенциала металла. Разновесный (обратимый) потенциал (φр) рассчитывается по уравнению Нернста. Равновесный потенциал анодной реакции равен φрк = φрме = φ0ме + 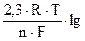
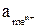
где 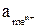 – активность ионов металла в растворе
– активность ионов металла в растворе
Для расчета равновесного потенциала катодной реакции φрк нужно знать, какой компонент коррозионной среды будет окислителем. В водных растворах окислителями, как правило, являются ионы водорода и растворенный кислород.
В этом случае основная катодная реакция это восстановление ионов водорода: Н3О+ + е → ½ Н2 + H2O
Равновесный потенциал этой реакции рассчитывается по уравнению
φрН+/Н2 = φ0Н+/Н2 + 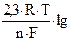 (аН+ / PH2½ )
(аН+ / PH2½ )
где φ0Н+/Н2 – стандартный потенциал водородного электрода;
n – число электронов, принимающих участке в электродной реакции;
аН+ – активность ионов водорода в растворе;
PН2 – парциальное давление водорода.
Если PH2 = 1 ат., Т = 298 К (25 °С) то φрН+/Н2 = – 0,0059 рН
Равновесный потенциал катодной реакции равен
φрО2/ОН- = φ0О2/ОН- + 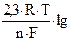 (PО2½ / а4ОН-)
(PО2½ / а4ОН-)
Таким образом, зная уравнения для расчета разновесных потенциалов анодной и катодных реакций, а также условие коррозионного воздействия (кислотность среды, концентрацию раствора и т.д.) можно рассчитать энергию Гиббса (ΔG) по уравнению
∆G = – n·F·∆φр
и ответить на вопрос о возможности протекания процесса коррозии в данных условиях.
Коррозионные диаграммы
Наиболее полно характеризуют протекание коррозионного процесса поляризационные кривые анодного и катодного процессов – коррозионные диаграммы. Поляризационные кривые выражают зависимость силы тока от потенциала металла при протекании окислительной и восстановительной реакции ί = f (φ) или φ =f (ί).
Коррозионные диаграммы служат основой для выяснения принципиальных особенностей того или иного метода.
Коррозионные процессы являются сопряженными, т.е. окислительная и восстановительная реакции подчиняются двум принципам:
а) Принцип независимости, по которому закономерности сопряженных реакций при их совместном протекании остаются такими же, как и при протекании каждой реакции в отдельности;
б) Принцип стационарности, согласно которому при установленном стационарном потенциале коррозии φст скорость окислительной реакции равна скорости восстановительной, то есть ί ок. = ί вост.
Это наглядно иллюстрируется поляризационными кривыми (см. рис. 1).
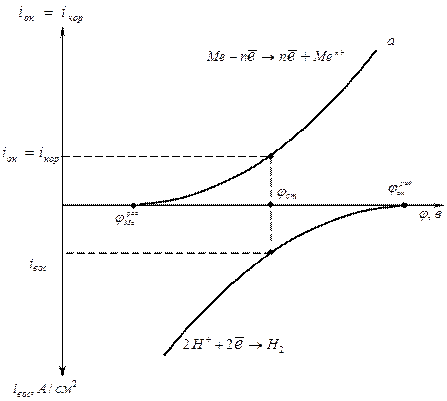 |
Рисунок 1 – Коррозионная диаграмма
При установившемся стационарном потенциале ίок. = ίвост., т. е. скорости анодного и катодного процесса равны и ток в системе равен нулю.
Экспериментальная часть
Выбранный для данной работы объемный метод очень прост. Он основан на том, что количество растворенного металла эквивалентно количеству выделившегося водорода при коррозии с водородной деполяризацией.
1. Подготовка образцов
Образцами для испытаний служат серый чугун, углеродистая сталь, хромоникелевая сталь. В качестве коррозионной среды выбрана 10 % серная кислота.
Перед началом эксперимента образцы тщательно зачищают наждачной бумагой, обезжиривают раствором соды, промывают проточной водой, вытирают фильтрованной бумагой; после этого измеряют их поверхность штангенциркулем.
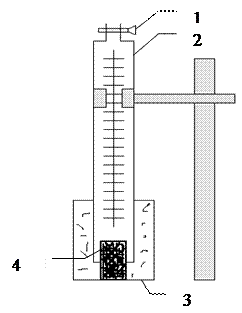 Подготовленные таким образом образцы помещают в стакан с раствором серной кислоты, опускают бюретку до дна стакана и засасывают грушей раствор до верхней метки. После этого записывают уровень в бюретках (это значение является нулевым). В дальнейшем в течение 60 минут записывают количество выделившегося водорода через каждые 10 минут. На рис. 2 представлена схема установки эксперимента.
Подготовленные таким образом образцы помещают в стакан с раствором серной кислоты, опускают бюретку до дна стакана и засасывают грушей раствор до верхней метки. После этого записывают уровень в бюретках (это значение является нулевым). В дальнейшем в течение 60 минут записывают количество выделившегося водорода через каждые 10 минут. На рис. 2 представлена схема установки эксперимента.
Рисунок 2 – Установка для определения скорости коррозии по количеству выделившегося водорода.
1 – кран; 2 – бюретка; 3 – стакан; 4 – образец
После окончания опыта осторожно открывают краны на бюретках и спускают оставшийся раствор кислоты. Образцы из стакана вынимают, тщательно споласкивают проточной водой и вытирают фильтрованной бумагой. Раствор из стакана сливают в склянку с надписью «слив».
2. Расчеты скорости коррозии
Расчет скорость коррозии вычисляют либо в весовых единицах, отнесенных к единице поверхности (см2, м2) в единицу времени (час, сутки, год), либо в усредненном уменьшении толщины образца в микронах, миллиметрах или сантиметрах год.
При равномерной коррозии эта величина представляет большой интерес для конструкторов, так как дает оценку долговечности изделия.
При окислении металла ионами водорода – 1 моль выделившегося водорода соответствует 2 г-экв. окислившегося металла, таким образом потери металла составляют:
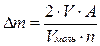 , г (1)
, г (1)
где V – объем выделившегося H2, см3;
Vмоль – молекулярный объем газа, мл (22400 см3);
A – атомный вес металла, г;
n – валентность ионов металла, в нашем случае валентность иона равна 2.
Подставим уравнение (1) в уравнение скорости коррозии
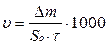 ,
,
где υ – скорость коррозии в г/м2·ч, мг/дм2·сутки, г/м2 ·год
Δm – потеря массы образца, г;
τ – длительность испытания, час;
S0 – измеренная поверхность, см2;
10000 - коэффициент перевода см2 в м2.
Для расчета скорости коррозии в единицах г/м2 ·год применяют формулу
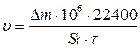 г/м2 ·год
г/м2 ·год
где τ – время, час (в году 8760 часов)
Расчет уменьшения толщины образца или глубинный показатель (l) коррозии в единицу времени легко рассчитать, зная плотность окисляемого металла ρ.
l 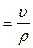
l 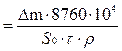 , мм/год
, мм/год
где υ – скорость растворения, мм/год;
ρ – плотность металла, для железа равна 7,86 г/см3.
Рассчитывают глубинный показатель коррозии, мм/год для каждого образца и результаты заносят в таблицу 1.
Таблица 1 – Результаты опыта и расчетные данные показателя коррозии
| Сплав | Поверхность образца, см3 | Показания бюретки через τ мин | Количество выделившегося Н2, см3 через τ мин | Потери Δm, гчерез 1 час | Глубина коррозии, мм/год | ||||||||||||
По расчетным данным строят график зависимости скорости коррозии от времени для каждого образца (см. рис 3).
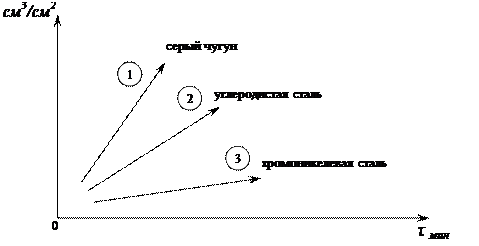 |
Рисунок 3 – Зависимость количества выделившегося водорода с единицы поверхности образца от времени.
Вывод: скорость коррозии зависит от типа сплава, чем меньше показатель глубинной коррозии, тем больше коррозионная стойкость окисляемого сплава.
В таблице 2 приведены данные ГОСТа 5272–50, позволяющие оценить стойкость металла по десятибалльной шкале.
Таблица 2 – ГОСТ 5272–50 на коррозионную стойкость металла
| Группа стойкости | Скорость коррозии, мм/год | Балл стойкости | Потери веса в г/ м2·час, для железа и его сплавов |
| Совершено стойкие | 0,001 | 0,0009 | |
| Весьма стойкие | 0,001–0,005 | 0,0009–0,0045 | |
| 0,005–0,010 | 0,0045–0,0090 | ||
| Стойкие | 0,01–0,05 | 0,009–0,045 | |
| 0,05–0,10 | 0,045–0,090 | ||
| Пониженной стойкости | 0,1–0,5 | 0,09–0,45 | |
| 0,5–1,0 | 0,45–0,90 | ||
| Малостойкие | 1,0–5,0 | 0,9–4,5 | |
| 5,0–10,0 | 4,5–9,1 | ||
| Нестойкие | больше 10 | больше 9,2 |
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Что такое коррозия, её виды?
2. Какое необходимое условие протекания электрохимической коррозии с точки зрения термодинамики процесса.
3. Какие существуют методы контроля скорости коррозионного процесса.
4. Почему скорость окисления металла определяется количеством выделившегося водорода?
5. Как рассчитывается энергия Гиббса при электрохимической коррозии?
6. Как рассчитывается равновесный потенциал в реальных условиях коррозии (концентрации, температуры и.т.д.).
7. Как рассчитывается потеря массы металла по количеству выделившегося водорода
8. Что такое глубина коррозии?
9. Коррозионные диаграммы и их анализ при водородной деполяризации.
Список литературы
1. И.В. Семенова, Г.М. Флорианович, А.В. Хорошилов. Коррозия и защита от коррозии. «Физматлит» М., 2002, с. 328
2. А.С. Неверов, Д.А. Родченко. Коррозия и защита материалов. «Высшая школа» М., 2008, с. 224
3. В.В. Скорчеллети. Теоретические основы коррозии металлов. – Л.: Химия, 1973. – 264 с., с 164-175
4. Г.Г. Улиг. Коррозия металлов, Металлургия М., 1966, с 212-230.
5. Н.П. Жук. Курс теории коррозии и защиты металлов: учебное пособие для металлургических специальностей вузов – М.: Металлургия, 1976. – 472 с.
6. И.Я. Климов. Коррозия химической аппаратуры и коррозионностойкие материалы. М.: Машиностроение, 1967. – 468 с.
Учебное издание
Николай Ульянович Быкадоров
Тамара Викторовна Крекалева