Тема: Ароматические углеводороды (Арены)
Арены (ароматические углеводороды) – органические соединения, имеющие общую формулу СnH2n –6, а в составе молекулы бензольное кольцо (ядро).
Бензольное кольцо – это цикличная группа шести атомов углерода; структуру в виде кольца предложил Ф. А. Кекуле в 1865 г.
Простейшим представителем аренов является бензол С6Н6. Среди других представителей можно отметить, например, кумол (изопропилбензол) C6H5CH(CH3)2.
Формулы бензола
| Полная структурная (формула, предложенная Ф.А. Кекуле) | 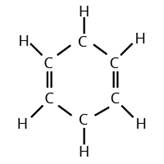
|
| Сокращенная структурная (формула, предложенная Ф.А. Кекуле) | 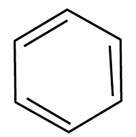
|
| Сокращенная структурная с сопряженными связями | 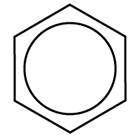
|
Бензол – первый представитель класса аренов (ароматических углеводородов). Каждый атом углерода в молекуле бензола С6Н6 имеет 4 валентных электрона: s 1 p 3. Тип гибридизации атомов углерода в бензольном кольце молекулы аренов, как и у алкенов, – sp 2.
sp 2 гибридизация – это смешивание одного s и двух p электронных облаков и образование трёх одинаковых (гибридных). Гибридные облака участвуют в образовании 3 δ-связей, лежащих на плоскости. Оставшееся у каждого из шести атомов углерода негибридизованное третье p -облако имеет форму гантели. Шесть p -облаков, перекрываясь с соседними над и под плоскостью δ-связей, участвует в образовании общего 6-электронного облака, которое является общим для всех атомов углерода.
Свойства бензола и других ароматических соединений обусловлены электронным строением молекулы бензола.
Сопряжение π-связей в молекуле бензола
Образование пи-связей в молекуле бензола обусловлено тем, что негрибридизованные облака образуют общие электронные плотности в виде колец над и под плоскостью молекулы бензола. Обратите внимание, что в результате образуется общее пи-электронное облако, а все связи между атомами углерода в молекуле бензола оказываются одинаковыми (их еще называют полуторными). Именно пи-электронные облака являются объяснением того факта, что – в отличие от первоначального варианта представления молекулярной формулы бензола с чередованием одинарных и двойных связей – бензол не проявляет выраженных свойств алкенов.
Изомеры и гомологи
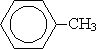
Метилбензол (толуол)
Диметилбензол (ксилол)
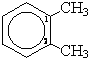 1,2-диметилбензол (орто-ксилол)
1,2-диметилбензол (орто-ксилол)
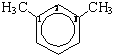 1,3-диметилбензол (мета-ксилол)
1,3-диметилбензол (мета-ксилол)
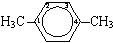 1,4-диметилбензол (пара-ксилол)
1,4-диметилбензол (пара-ксилол)
Основой названия замещенного производного бензола является слово "бензол". Атомы в бензольном кольце нумеруются, начиная от старшего заместителя к младшему. Пример: 1-метил-2-этилбензол, а не 1-этил-2-метилбензол. Если заместители одинаковы, то нумерацию проводят по самому краткому пути. Пример: 1,3-диметилбензол, а не 1,5-диметилбензол.
Приставки орто-, мета-, пара- (от греческого ортос - прямой, мета - после, через, между, пара - против, возле, мимо) в названиях органических веществ (сокращенно: о-, м-, п-) используются для указания взаимного расположения двух заместителей в бензольном кольце.
Физические свойства бензола
Бензол – бесцветная жидкость с характерным запахом, которая кипит при 80,1 °С, ρ = 0,876 г/cм3. Бензол очень огнеопасен! Токсичен!
Бензол является хорошим растворителем. В пробирку нальем 1 мл дистиллированной воды и добавим несколько капель масла. Масло не растворяется в воде даже после перемешивания содержимого. Во вторую пробирку нальем 1 мл бензола. Перемешаем содержимое. Масло растворяется в бензоле. Однако ввиду высокой токсичности, использование бензола в качестве растворителя нежелательно.