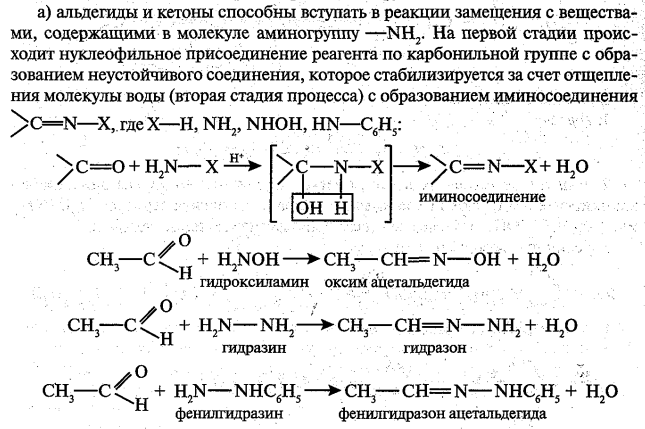
Реакции замещения в альдегидах.
1. α -Галогенирование
Альдегиды легко вступают в реакцию с галогенами (Cl2, Br2, I2) с образованием ɑ-галогенпроизводных.
Такой эффект наблюдается только для ɑ-атома углерода, т.е атома, следующего за альдегидной группой, независимо от длины углеродного радикала.
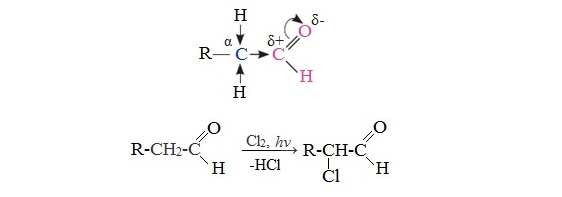
При избытке галогена замещению подвергаются все атомы водорода при ɑ-углеродном атоме:
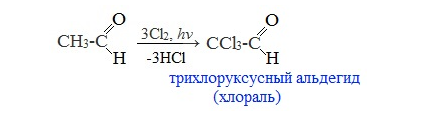
Хлораль обладает снотворным действием. На основе хлораля получают средства борьбы с насекомыми (инсектициды), в том числе хлорофос, а также различные гербициды.
Замещение атома кислорода карбонильной группы
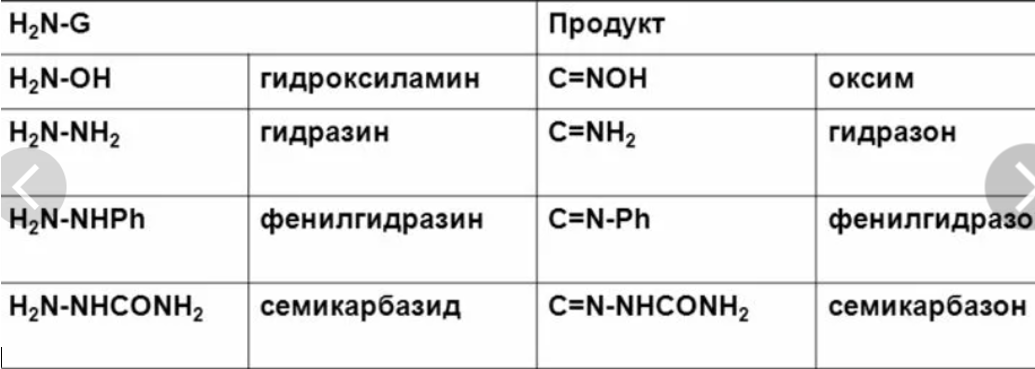
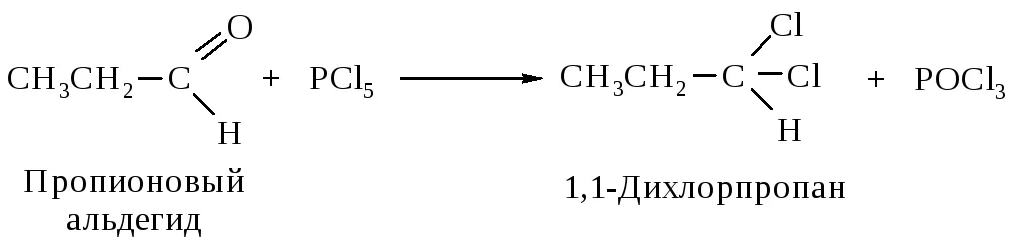
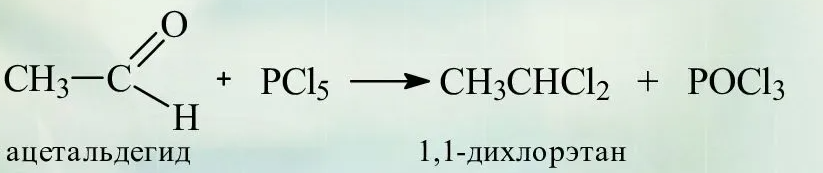
Б) взаимодействие с пентахлоридом фосфора
Реакции поликонденсации
Конденсацией называется реакция, приводящая к усложнению углеродного скелета и возникновению новой углеродной связи, причем из двух или более относительно простых молекул образуется новая, более сложная молекула. Обычно в результате реакции конденсации выделяется молекула воды или другого вещества.
Конденсация, приводящая к образованию высокомолекулярных соединений, называется реакцией поликонденсации.


Реакции полимеризации
Циклическая полимеризация (тримеризация, тетрамеризация)
При взаимодействии молекул альдегидов возможно также образование циклических соединений.
а) Тример метаналя получается при перегонке подкисленного раствора формальдегида:
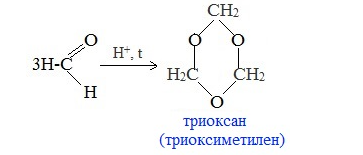
Триоксан используется для получения полиформальдегида (полиоксиметилена) с высокой молекулярной массой, обладающего повышенной стабильностью и механической прочностью.
Как таковой он используется в качестве связующего в текстиле, изделиях из дерева и т.д. Триоксан соединяется с гексамином и сжимается в твердые бруски для изготовления таблеток гексаминового топлива, используемых военными и туристами в качестве топлива для приготовления пищи.
|
|
б) Полимеризация ацетальдегида в присутствии следов серной кислоты приводит к образованию в зависимости от условий двух циклических продуктов — паральдегида и метальдегида. Паральдегид образуется, если реакцию проводить при 200С, а метальдегид — при 00С:
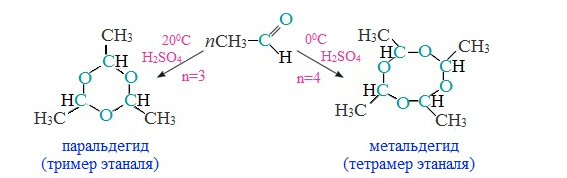
Паральдегид — пример успокаивающего и снотворного средства. Если дать человеку немного паральдегида, растворенного в воде, то уже через 10—15 минут он успокоится и заснет. Паральдегид — жидкость (т. кип. 1280С).
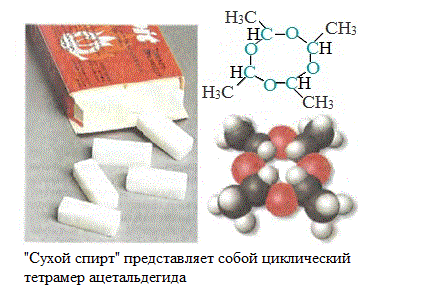
Метальдегид — твердое вещество, используется в быту как сухое горючее под названием «сухой спирт».
Альдольно-кротоновая конденсация
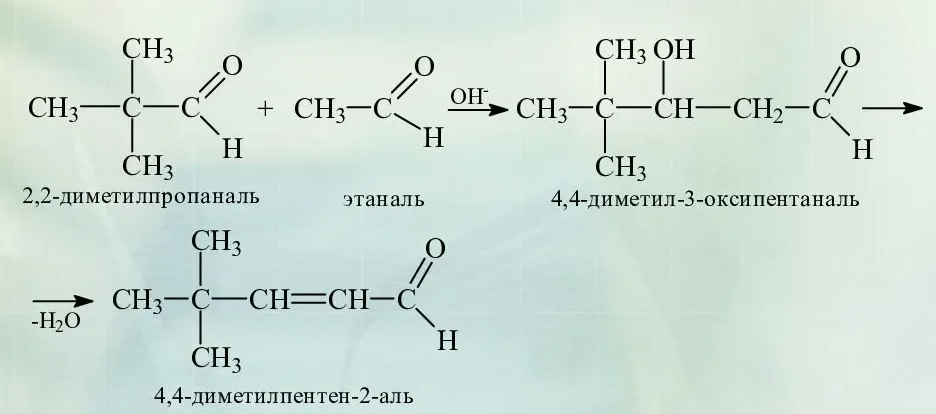
Альдольная конденсация- реакция объединения ДВУХ молекул альдегидов или кетонов или альдегида и кетона в одну более сложную молекулу, совмещающую в себе одновременно функции альдегидов и кетонов. Такие реакции возможны, если у атома углерода в ɑ-положении есть хотя бы один атом водорода:
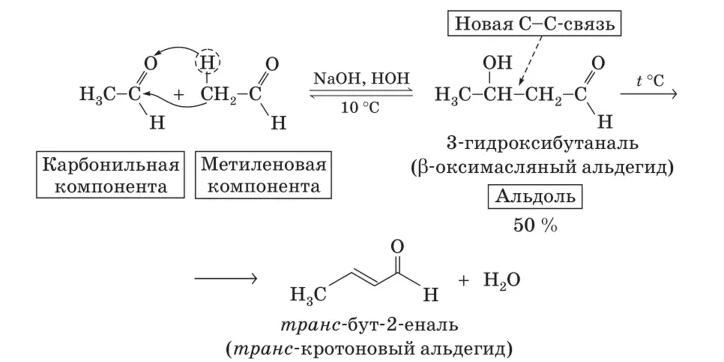
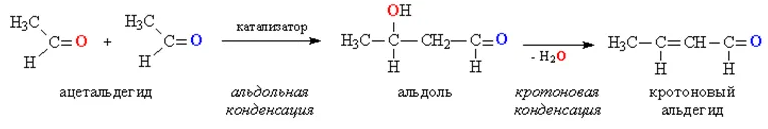
При нагревании альдоль легко дегидратируется с образованием простейшего непредельного альдегида (кротонового)
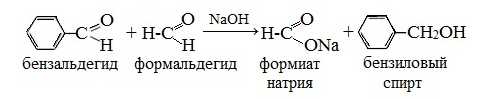
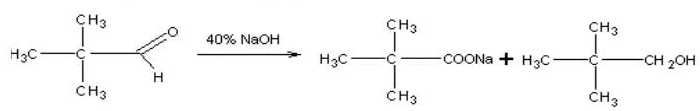
Реакция Канниццаро – альдегиды, не имеющие в α-положении к карбонильной группе (=С=O) атомов водорода, при действии щелочи претерпевают окислительно-восстановительное диспропорционирование с образованием спиртов и карбоновых кислот.
При обработке ароматических и гетероциклических альдегидов, а также алифатических альдегидов, водным или водно-спиртовым раствором щелочи происходит своеобразное превращение: одна молекула альдегида восстанавливается в спирт за счет окисления другой молекулы альдегида в карбоновую кислоту. Карбоновая кислота, взаимодействуя со щелочью, дает соответствующую соль.
|
|
Реакция самоокисления-самовосстановления.
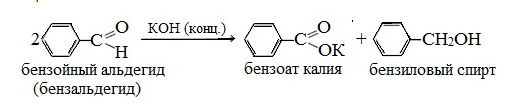
Из алифатических альдегидов к подобному превращению способны муравьиный альдегид и альдегиды, у которых карбонильная группа связана с третичным атомом углерода.
Окислительно-восстановительная реакция ароматических альдегидов была открыта в 1853 г. итальянским химиком С. Канниццаро.
Он обнаружил, что при нагревании бензальдегида с поташом (К2СО3) исчезает запах горького миндаля, характерный для этого альдегида.
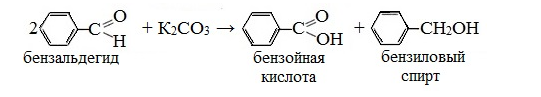
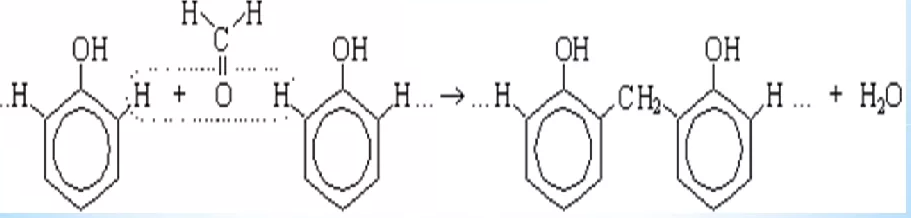
В реакцию Канниццаро могут вступать и два различных альдегида (перекрестная реакция Канниццаро). Так, из смеси бензальдегида C6H5CHO и формальдегида HCHO образуется бензиловый спирт C6H5CH2OH и муравьиная кислота HCOOH. Формальдегид превращается в муравьиную кислоту в виде формиата натрия, т.к. реакционная среда щелочная.