Коагуляция - это самопроизвольный физический процесс укрупнения частиц дисперсной фазы в результате потери агрегативной устойчивости под влиянием внешних факторов.
Все эти внешние воздействия приводят к изменению строения ДЭС, имеющегося на поверхности коллоидной частицы. Например, при длительном хранении золей может произойти спонтанная коагуляция, обусловленная потерей стабилизатора. Коагуляция происходит при нагревании золей в результате десорбции стабилизатора или при замораживании; при механическом воздействии на золь, например, при перемешивании, при разбавлении или концентрировании золя и даже в присутствии чужеродной поверхности (гетерокоагуляция).
Очень часто коллоидный раствор разрушается под действием электролитов. Коагуляцию вызывают все электролиты, даже стабилизаторы.
Индифферентные электролиты (т.е. электролиты, не имеющие ионов, способных достраивать кристаллическую решетку коллоидной частицы) не влияют на термодинамический потенциал, но уменьшают дзета-потенциал в результате сжатия диффузного слоя. Чем больше концентрация электролита, тем меньше диффузный слой и меньше ξ-потенциал.
Неиндифферентные электролиты изменяют и термодинамический, и дзета-потенциалы. При малых концентрациях они оказывают большее влияние на φ-потенциал, при больших концентрациях – на ξ-потенциал. Кроме того, при введении неиндифферентного электролита возможна перезарядка коллоидной частицы.
Потеря устойчивости в результате разряжения коллоидной частицы и уменьшения φ-потенциала называется нейтрализационной коагуляцией. Потеря устойчивости коллоидной системы, связанная с сжатием ДЭС и уменьшением ξ-потенциала, называется концентрационной коагуляцией.
Наименьшее количество электролита, необходимое для коагуляции 1 м3 коллоидного раствора, называется порогом коагуляции (γ).

при V << W, где С – концентрация раствора электролита (коагулянта), моль/л; V – его объем, вызывающий коагуляцию, м3; W – объем коллоидного раствора, м3.
Чем меньше порог коагуляции, тем меньше нужно добавить коагулянта для разрушения золя.
"Рабочим" ионом коагулянта является ион, заряд которого противоположен заряду коллоидной частицы (или одинаков с зарядом противоионов). Его называют коагулирующим ионом.
Согласно правилу Щульце-Гарди,
«Чем больше заряд коагулирующего иона, тем меньше порог коагуляции. Коагулирующая способность двухвалентных ионов ~ в 50 раз, а трехвалентных ~ в 1000 раз больше, чем одновалентных».
Более точно зависимость порога коагуляции от заряда коагулирующего иона описывается уравнением Дерягина:

где А – постоянная; ε – диэлектрическая проницаемость среды; Т – температура; Z – заряд коагулирующего иона.
Скорость коагуляции зависит от концентрации коагулирующего электролита.
При низкой концентрации электролита коагуляция вообще не происходит; при превышении некоторого порога концентраций начинается укрупнение коллоидных частиц, но не все столкновения частиц кончаются их слипанием. Такая область протекания процесса называется медленной коагуляцией. Скорость медленной коагуляции зависит от концентрации электролита, увеличиваясь при ее повышении.
При большой концентрации электролита скорость коагуляции перестает зависеть от концентрации, т.к. все столкновения частиц заканчиваются их слипанием – это область быстрой коагуляции.
В случае быстрой коагуляции процесс можно описать уравнением Смолуховского:

где n0 – общее число частиц в единице объема золя до коагуляции; n – число частиц к моменту времени τ; К – константа скорости коагуляции.
Теоретическое значение константы скорости коагуляции рассчитывается по уравнению:

(м3/с), где R - газовая постоянная (8,31 Дж/моль град), Т - температура (град. Кельвина), η - вязкость среды (Н с/м2), N - число Авогадро (6,02 × 1023).
Если экспериментально определенное значение константы меньше, чем теоретическое, в системе происходит медленная коагуляция.
В случае медленной коагуляции необходимо учитывать эффективность соударений (ε):
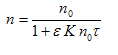
.