Задание: Таблицу в тетрадь. 
Июня
1-2. Тема: Практическая работа. Решение задач на тему: основные понятия и законы химии.
Задание: Выписать в тетрадь алгоритм решения задач. Решить задачи в конце практической работы.
Практическая работа №16-17
Тема: Решение задач на тему: основные понятия и законы химии.
Цель: формирование умений применять основные законы для вычислений по химическим уравнениям, используя алгоритм решения задач на нахождение относительной молекулярной массы, определение массовой доли химических элементов в сложном веществе.
Время выполнения: 2 часа
Теоретический материал
- Закон сохранения массы веществ: «Масса всех веществ, которые вступают в химическую реакцию, равна массе всех продуктов реакции».
- Молярная масса вещества M выражается в г/моль. Она численно равна относительной молекулярной массе этого вещества
 (для молекул)
(для молекул)  , (для атомов)
, (для атомов)  .
. - Количество вещества
 , (1)
, (1)
где n – количество вещества, моль; m – масса вещества, г;
M – молярная масса, г/моль
или  , (2)
, (2)
где V – объем вещества, л.
V  - молярный объем, л/моль.
- молярный объем, л/моль.
- Масса исходного вещества
 . (3)
. (3)
Объем исходного вещества  . (4)
. (4)
- Молярный объем любого газа при нормальных условиях (н.у.) равен 22,4 л/моль.
Алгоритм решения задач
- Прочитайте текст задачи.
- Запишите условие и требование задачи с помощью общепринятых обозначений.
- Составьте уравнение реакции.
- Подчеркните формулы веществ, о которых идет речь в условии задачи.
- Надпишите над подчеркнутыми формулами исходные данные.
- Рассчитайте молярные массы веществ, о которых идет речь в условии задачи.
- Рассчитайте количество данного по условию задачи вещества.
- Определите соотношение веществ в данной реакции (по коэффициентам).
- Составьте пропорцию, рассчитайте количество определяемого вещества.
- Используя формулу (3), вычислите массу исходного вещества. Используя формулу (4), вычислите объем исходного вещества.
- Запишите ответ.
Примеры решения задач
Задача №1.
Какая масса воды образуется при сгорании 1 г глюкозы  , если реакция протекает по схеме:
, если реакция протекает по схеме:

 +
+ 
Решение.
Составим уравнение данной реакции:
 + 6
+ 6 
Запишем информацию, которую дает это уравнение:
 + 6
+ 6 
1 моль 6 моль
180 г 6 х 18 = 108 г
Следовательно:
при сгорании 180 г  образуется 108 г
образуется 108 г  ;
;
при сгорании 1 г  образуется х г
образуется х г  .
.
Отсюда: 
Ответ: при сгорании 1 г глюкозы образуется 0,6 г воды.
Задача №2.
Какая масса магния Mg вступает в реакцию с серной кислотой  , если в результате реакции выделяется 5,6 л водорода
, если в результате реакции выделяется 5,6 л водорода 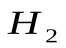 при н.у.?
при н.у.?
Решение.
Запишем уравнение реакции и ту информацию, которую оно дает:

1 моль 1 моль
24 г 22,4 л
22,4 л 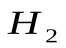 выделяется, если в реакцию вступают 24 г
выделяется, если в реакцию вступают 24 г  ;
;
5,6 л 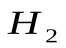 выделяется, если в реакцию вступают х г
выделяется, если в реакцию вступают х г  .
.
Отсюда:

Ответ: 5,6 л 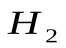 выделяется, если в реакцию вступают 6 г
выделяется, если в реакцию вступают 6 г  .
.
Если в условии задачи даются массы или объемы двух исходных веществ, то начинать решение этой задачи следует с выяснения того, какое исходное вещество дано в избытке, а какое – в недостатке.
Задача №3. Смешано 7,3 г  с 4,0 г
с 4,0 г  . сколько г
. сколько г  образуется?
образуется?
Уравнение реакции: 
Решение.
Определяем, какое вещество находилось в избытке, какое в недостатке. Для этого рассчитаем данное число молей  и
и  :
:
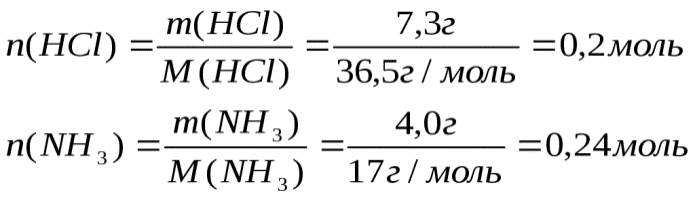
Уравнение реакции показывает, что 1 моль  взаимодействует с 1 моль
взаимодействует с 1 моль  значит 0,2 моль
значит 0,2 моль  взаимодействуют с 0,2 моль
взаимодействуют с 0,2 моль  таким образом, 0,04 моль
таким образом, 0,04 моль  останутся непрореагировавшими,
останутся непрореагировавшими,  дан в избытке. Расчет следует вести во веществу, данному в недостатке, т.е. по
дан в избытке. Расчет следует вести во веществу, данному в недостатке, т.е. по  :
:
1 моль  дает 1 моль
дает 1 моль  ;
;
0,2 моль  дает
дает  моль
моль  ;
;
 = 0,2 моль
= 0,2 моль  =
=  (
( )
)
Рассчитаем молярную массу  :
:
 =
=  .
.
Рассчитаем, сколько граммов  образуется в результате реакции:
образуется в результате реакции:
 (
( )
) 
Ответ: образуется 10.7 г  .
.