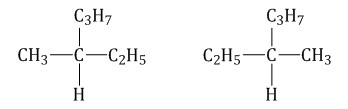Виды изомерии
Различают два основных вида изомерии: структурную и пространственную (стереоизомерию).
Структурные изомеры отличаются друг от друга взаимным расположением атомов в молекуле; стереоизомеры — расположением атомов в пространстве.
Структурная изомерия
Структурные изомеры – соединения с одинаковым составом, но различным порядком связывания атомов, т.е. с различным химическим строением. Молекулярная формула у структурных изомеров одинаковая, а структурная различается.
1. Изомерия углеродного скелета: вещества различаются строением углеродной цепи, которая может быть линейная или разветвленная.
Например, молекулярной формуле С5Н12 соответствуют три изомера:

2. Изомерия положения обусловлена различным положением кратной связи, функциональной группы или заместителя при одинаковом углеродном скелете молекул.
2.1. Изомерия положения функциональной группы. Например, существует два изомерных предельных спирта с общей формулой С3Н8О: пропанол-1 (н-пропиловый спирт) пропанол-2 (изопропиловый спирт):

2.2. Изомерия положения кратной связи может быть вызвана различным положением кратной (двойной или тройной) связи в непредельных соединениях. Например, в бутене-1 и бутене-2:

2.3. Межклассовая изомерия – ещё один вид структурной изомерии, когда вещества из разных классов веществ имеют одинаковую общую формулу.
Например, формуле С2Н6О соответствуют: спирт (этанол) и простой эфир (диметиловый эфир):

Пространственная изомерия
Пространственные изомеры – это вещества с одинаковым составом и химическим строением, но с разным пространственным расположением атомов в молекуле. Виды пространственной изомерии – геометрическая (цис — транс) и оптическая изомерия.
1. Геометрическая изомерия (или цис-транс -изомерия).
Геометрическая изомерия характерна для соединений, в которых различается положение заместителей относительно плоскости двойной связи или цикла. Например, для алкенов и циклоалканов.
Двойная связь не имеет свободного вращения вокруг своей оси.
Поэтому заместители у атомов углерода при двойной связи могут быть расположены либо по одну сторону от плоскости двойной связи (цис -изомер), либо по разные стороны от плоскости двойной связи (транс -изомер). При этом никаким вращением нельзя получить из цис -изомера транс -изомер, и наоборот.
Например, бутен-2 существует в виде цис — и транс -изомеров

1,2-Диметилпропан также образует цис-транс -изомеры:
Геометрические изомеры различаются по физическим свойствам (температура кипения и плавления, растворимость, дипольный момент и др.). Например, температура кипения цис -бутена-2 составляет 3,73 оС, а транс -бутена-2 0,88оС.
При этом цис — транс -изомерия характерна для соединений, в которых каждый атом углерода при двойной связи С=С (или в цикле) имеет два различных заместителя.
Например, в молекуле бутена-1 C H2= C H-CH2-CH3 заместители у первого атома углерода при двойной связи (два атома водорода) одинаковые, и цис — транс -изомеры бутен-1 не образует. А вот в молекуле бутена-2 CH3— C H= C H-CH3 заместители у каждого атома углерода при двойной связи разные (атом водорода и метильная группа CH3), поэтому бутен-2 образует цис — и транс -изомеры.
Таким образом, для соединений вида СH2=СHR и СR2=СHR’ цис — транс -изомерия не характерна.
Оптическая изомерия
Оптические изомеры – это пространственные изомеры, молекулы которых соотносятся между собой как предмет и несовместимое с ним зеркальное изображение.
Оптическая изомерия свойственна молекулам веществ, имеющих асимметрический атом углерода.
Асимметрический атом углерода — это атом углерода, связанный с четырьмя различными заместителями.

Такие молекулы обладают оптической активностью — способностью к вращению плоскости поляризации света при прохождении поляризованного луча через раствор вещества.
Например, оптические изомеры образует 3-метилгексан: